
【题目】硫酸是一种重要的化工产品,硫酸的消耗量常被视为一个国家工业发展水平的一种标志。目前的重要生产方法是“接触法”,有关接触氧化反应2SO2+O2![]() 2SO3的说法不正确的是
2SO3的说法不正确的是
A.该反应为可逆反应,故在一定条件下二氧化硫和氧气不可能全部转化为三氧化硫
B.达到平衡后,反应就停止了,故此时正、逆反应速率相等且均为零
C.一定条件下,向某密闭容器中加入2 mol SO2和1 mol O2,则从反应开始到达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等
D.在利用上述反应生产三氧化硫时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题
【答案】B
【解析】
A.可逆反应是在一定条件下不能进行彻底的反应,正反应和逆反应同时进行,该反应为可逆反应,故在一定条件下SO2和O2不可能全部转化为SO3 ,故A正确;
B.达到平衡后,正反应速率和逆反应速率相等,是动态平衡,速率不能为0,故B错误;
C.一定条件下,向某密闭容器中加入2 mol SO2和1 mol O2,则从反应开始到平衡的过程中,由于反应物浓度不断减小、生成物浓度不断增大,正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等达到平衡,故C正确;
D.反应是放热反应,但为了反应速率需要一定温度,催化剂活性最大,在常压下二氧化硫的转化率已经很高,改变压强对转化率影响不大,故D正确;
故答案选B。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】已知![]() 有相同容积的定容密封容器甲和乙,甲中加入
有相同容积的定容密封容器甲和乙,甲中加入![]() 和
和![]() 各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
A.甲、乙提高相同温度 B. 甲中加入0.1mol He,乙不改变
C.甲降低温度,乙不变 D. 甲增加0.1mol ![]() ,乙增加0.1mol I2
,乙增加0.1mol I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镧系金属元素铈(Ce)常见有+3、+4两种价态,铈的合金耐高温,可以用来制造喷气推进器零件。铈元素在自然界中主要以氟碳铈矿形式存在,其主要化学成分为CeFCO3。工业上利用氟碳铈矿提取CeCl3的一种工艺流程如下:

(1)为了提高焙烧效率可以采取的措施有______________。(回答两条即可)
(2)假设参与酸浸反应的CeO2和CeF4的物质的量之比为3∶1,试写出相应的化学方程式: ______。有同学认为酸浸过程中用稀硫酸和H2O2替换盐酸更好,其理由是:___________。
(3)常温下,当溶液中的某离子浓度≤1.0×10-5 mol·L-1时,可认为该离子沉淀完全。据此,在生成Ce(OH)3的反应中,加入NaOH溶液至pH至少达到________时,即可视为Ce3+已完全沉淀。{Ksp[Ce(OH)3]=1.0×10-20}。
(4)向Ce(BF4)3中加入KCl溶液,该反应能发生的原因是____________________。
(5)雾霾中含有的污染物NO可以被含Ce4+的溶液吸收,生成NO2-、NO3-,用电解的方法可将上述吸收液中的NO2-转化为稳定的无毒气体,同时将Ce3+再生为Ce4+,其原理如图所示。

①NO2-从电解槽的________(填字母序号)口进入。
②每生成标准状况下11.2 L无毒气体,同时可再生Ce4+________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定的精度也越来越高。现有一种简单可行的测定方法,具体步骤为:
①准确称取mg干燥后的NaCl固体细粒并转移到定容仪器A中;
②用滴定管向A仪器中加苯,不断振荡,继续加苯到A仪器的刻度,
计算出NaCl固体的体积V cm3。
(1)步骤①中仪器A最好使用_______________(填序号)
A.量筒 B.烧杯 C.容量瓶 D.试管
(2)步骤②中是否用酸式滴定管还是用碱式滴定管_____________,理由是__________。
(3)能否用水代替苯_________,理由是_____________________。
(4)已知NaCl晶体中,靠得最近的Na+、Cl-间的距离为a cm(如图),则用上述方法测得的阿伏加德常数NA的表达式为_______________。
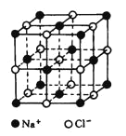
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
电离能(KJ/mol) | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15399 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
①某同学根据上述信息,推断B的核外电子排布如下图所示,该同学所画的电子排布图违背 ,B元素位于周期表五个区域中的 区。
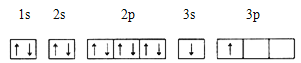
②ACl2分子中A的杂化类型为 ,ACl2的空间构型为 。
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①以体心立方堆积形成的金属铁中,其原子的配位数为 。
②写出一种与CN-互为等电子体的单质的电子式 。
③六氰合亚铁离子[Fe(CN)6]4-中不存在 。
A.共价键
B.非极性键
C.配位键
D.σ键
E.π键
(3)一种Al-Fe合金的立体晶胞如右图所示。请据此回答下列问题:
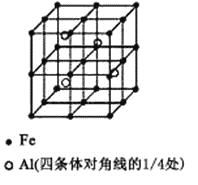
①确定该合金的化学式 。
②若晶体的密度=ρ g/cm3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为 cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种元素的原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍。请回答下列问题:
(1)F的基态原子价电子排布式为____________________ 。
(2)B、C、D、E的原子的第一电离能由小到大的顺序为_______________(用元素符号回答)
(3)下列关于B2A2分子和A2D2分子的说法正确的是______________
A 分子中都含有σ键和π键
B 中心原子都sp杂化
C 都是含极性键和非极性键的非极性分子
D 互为等电子体
E.B2A2分子的沸点明显低于A2D2分子
(4)F2+能与BD分子形成[F(BD)4]2+,其原因是BD分子中含有_________
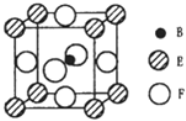
(5)由B、E、F三种元素形成的一种具有超导性的晶体,晶胞如图所示.B位于E和F原子紧密堆积所形成的空隙当中.与一个F原子距离最近的F原子的数目为_________,该晶体的化学式为_______.若该晶体的相对分子质量为M,阿伏加德罗常数为NA,B、E、F三种元素的原子半径分别为r1pm、r2pm、r3pm,则该晶体的密度表达式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一氧化碳变换反应CO + H2O![]() CO2 + H2中,有关反应条件改变使反应速率增大的原因分析不正确的是
CO2 + H2中,有关反应条件改变使反应速率增大的原因分析不正确的是
A.使用催化剂,活化分子百分数增大,有效碰撞几率增加
B.升高温度,活化分子百分数增大,有效碰撞几率增加
C.增大压强,单位体积内活化分子数增多,有效碰撞几率增加
D.增大c(CO),活化分子百分数增大,有效碰撞几率增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年秋天,毒奶粉事件震惊全国,这主要是奶粉中含有有毒的三聚氰胺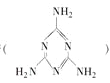 。下列关于三聚氰胺分子的说法正确的是
。下列关于三聚氰胺分子的说法正确的是
A. 所有碳原子采用sp3杂化,所有氮原子采用sp3杂化
B. 一个分子中共含有15个σ键
C. 属于极性分子,故极易溶于水
D. 分子内既有极性键又有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
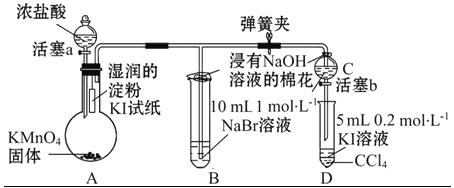
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)A中产生黄绿色气体,其电子式是_________________。
(2)验证氯气的氧化性强于碘的实验现象是_____________________________。
(3)B中溶液发生反应的离子方程式是_________________________。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com