
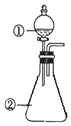
 用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )| 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
| D | 亚硫酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.稀盐酸与NaOH先反应,然后碳酸钠与盐酸反应生成碳酸氢钠;
B.常温下Al与浓硝酸发生钝化;
C.NaOH过量,开始不生成沉淀;
D.亚硫酸溶液与高锰酸钾酸性溶液发生氧化还原反应.
解答 解:A.稀盐酸与NaOH先反应,然后碳酸钠与盐酸反应生成碳酸氢钠,现象不合理,故A错误;
B.常温下Al与浓硝酸发生钝化,生成致密的氧化膜阻止反应的进一步发生,现象不合理,故B错误;
C.NaOH过量,开始不生成沉淀,现象不合理,故C错误;
D.亚硫酸溶液与高锰酸钾酸性溶液发生氧化还原反应,则溶液逐渐褪色,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应和现象为解答关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 检验方法 | 沉淀法 | 显色法 | 气体法 |
| 含义 | 反应中有沉淀产生或溶解 | 反应中有颜色变化 | 反应中有气体产生 |
| A. | NH4+-气体法 | B. | I--沉淀法 | ||
| C. | Na+-显色法 | D. | CO32--气体法和沉淀法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78g Na2O2与足量水充分反应时电子转移数为2NA | |
| B. | 25℃、101.3kPa时,11.2L H2中含有的原子数为NA | |
| C. | 4℃、101.3kPa时,54mL H2O中含有的分子数为3NA | |
| D. | 2L 1mol/L Na2SO4溶液中离子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠:供氧剂 | B. | 碱石灰:干燥剂 | ||
| C. | 小苏打:发酵粉主要成分 | D. | 纯碱:治疗胃酸过多的一种药剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.03mol/L | B. | 0.16mol/L | C. | 0.08mol/L | D. | 0.04mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
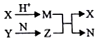 短周期元素A、B、C、D的原子序数依次增大,B和D同主族;X、Y、N分别是由以上四种元素中的两种组成的化合物,Z是由以上三种元素组成的化合物;若X与Y摩尔质量相同,Y为淡黄色固体,上述物质之间的转化关系如图所示(部分生成物省略),则下列说法中一定正确的是( )
短周期元素A、B、C、D的原子序数依次增大,B和D同主族;X、Y、N分别是由以上四种元素中的两种组成的化合物,Z是由以上三种元素组成的化合物;若X与Y摩尔质量相同,Y为淡黄色固体,上述物质之间的转化关系如图所示(部分生成物省略),则下列说法中一定正确的是( )| A. | 相对分子质量M>N,沸点N<M | B. | .简单离子半径:D>B>C>A | ||
| C. | Z为Na2CO3 | D. | .图中有两个氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com