
| A、将NaOH溶液和氨水溶液各稀释一倍,二者的OH-浓度均减小到原来的一半 |
| B、如果盐酸的浓度是醋酸浓度的两倍,则盐酸中的H+浓度是醋酸的两倍 |
| C、强电解质溶液的导电能力一定比弱电解质溶液强 |
| D、中和等体积、等物质的量浓度的盐酸和醋酸溶液,所需NaOH的物质的量相等 |


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:

| A、30℃时,向100克水中加入25克A物质,充分溶解后所得溶液是饱和溶液 |
| B、A物质的饱和溶液从30℃降温到10℃,变成不饱和溶液 |
| C、B物质的饱和溶液从30℃降温到20℃,其溶质质量分数减小 |
| D、30℃时,将B物质的不饱和溶液转变为饱和溶液,可以采取恒温蒸发溶剂的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
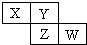 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )| A、X的气态氢化物比Y的稳定 |
| B、X与Y形成的化合物都易溶于水 |
| C、Z的非金属性比Y的弱 |
| D、原子半径:X>Y>Z>W |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、60 s内X的平均反应速率为0.001 mol?L-1?s-1 | ||
B、将容器的容积变为20 L,Z的新平衡浓度将等于原平衡浓度的
| ||
| C、若温度和体积不变,往容器内增加1 mol X,X的转化率将增大 | ||
| D、若升高温度,X的体积分数增大,则正反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、红棕色的NO2,加压后颜色先变深后变浅 |
| B、工业上合成NH3反应使用催化剂 |
| C、实验室可以采用排饱和食盐水收集Cl2 |
| D、由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
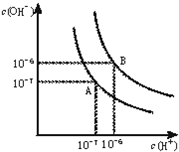 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com