
分析 (1)根据方程式计算出辛烷与氧气恰好反应时,辛烷与空气的体积比.
(2)辛烷与空气的体积比>a的最大值时,氧气不足,会产生CO有毒气体;
(3)辛烷与空气体积比<a的最大值时,氧气过量,会产生NO、NO2;
(4)当空气用量过大时,排出空气时会带走较多热量,从而降低了能量的利用率.
解答 解:(1)辛烷完全燃烧的反应为:2C8H18+25O2$\stackrel{点燃}{→}$16CO2+18H2O,则:$\frac{V({C}_{8}{H}_{18})}{\frac{1}{5}V(空气)}$=$\frac{2}{25}$,整理可得:a=$\frac{V({C}_{18}{H}_{18})}{V(空气)}$=$\frac{2}{25}$×$\frac{1}{5}$=0.016,
故答案为:0.016;
(2)若辛烷与氧气的体积比大于0.016时,氧气不足,除生成CO2和H2O外,还会产生CO有毒气体,污染大气,
故答案为:CO;
(3)若辛烷与氧气的体积比大于0.016时,氧气过量,在放电条件下,发生反应:N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO,2NO+O2═2NO2,会产生NO、NO2有毒气体,污染大气,
故答案为:NO、NO2;N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO,2NO+O2═2NO2;
(4)当辛烷与空气的体积比小于a的最大值时,从能量角度来分析,有利也有弊,如其有利的因素是氧气过量,有利于汽油完全燃烧,提高能源利用率,但是也有弊端,如:空气量相对增大,排走时带走的热量较多,利用率有所降低,
故答案为:空气量相对增大,排走时带走的热量较多,利用率有所降低.
点评 本题考查有关范围讨论的计算,题目难度中等,试题以环境污染及其防治为出发点进行命题,立意较高,同时要求的思维强度也较大,但其知识的立足点却较为基本,充分考查学生灵活应用基础知识的能力.


科目:高中化学 来源: 题型:填空题
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、
、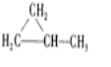 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是一种低碳能源,在全球能源危机和环境污染的背景下具有良好的发展前景.在催化剂作用下可用H2和CO合成甲醇,反应的化学方程式为2H2(g)+CO(g) $\stackrel{催化剂}{?}$CH3OH(g),三种物质的物质的量浓度随时间变化的关系如图1所示.试回答下列问题:
甲醇是一种低碳能源,在全球能源危机和环境污染的背景下具有良好的发展前景.在催化剂作用下可用H2和CO合成甲醇,反应的化学方程式为2H2(g)+CO(g) $\stackrel{催化剂}{?}$CH3OH(g),三种物质的物质的量浓度随时间变化的关系如图1所示.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解饱和食盐水:C1-+2H2O═H2↑+Cl2↑+OH- | |
| B. | 氢氧燃料电池在碱性介质中的正极反应式:O2+2H2O+4e-═4OH- | |
| C. | 弱酸酸式盐NaHB在水溶液中水解:HB-+H2O═H3O++B2- | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com