
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:填空题
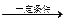 2NaH)。生成物氢化钠的电子式为________,含有的化学键为_____键(填“离子”、“共价”或“金属”)。
2NaH)。生成物氢化钠的电子式为________,含有的化学键为_____键(填“离子”、“共价”或“金属”)。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2CA3(g)。当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),右图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是____________。温度为T ℃时,将4a mol A2和2a mol C2放入密闭容器中,充分反应后测得平衡混
2CA3(g)。当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),右图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是____________。温度为T ℃时,将4a mol A2和2a mol C2放入密闭容器中,充分反应后测得平衡混 合气中CA3的体积分数为50%,则此时C2的转化率为______________。
合气中CA3的体积分数为50%,则此时C2的转化率为______________。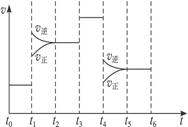
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Y、Z。回答下列问题:
Y、Z。回答下列问题: 一) + ;
一) + ;查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.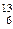 C C | B. N N | C. O O | D.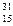 P P |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
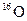 和
和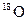 是氧元素的两种核素,
是氧元素的两种核素, 表示阿伏伽德罗常数,下列说法正确的是
表示阿伏伽德罗常数,下列说法正确的是A.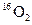 与 与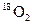  互为同分异构体 互为同分异构体 |
B.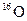 与 与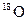 核外电子排布方式不同 核外电子排布方式不同 |
C.通过化学变化可以实现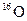 与 与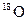 间的相互转化 间的相互转化 |
D.标准状况下,1.12L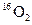 和1.12L 和1.12L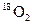 均含有0.1 均含有0.1 个氧原子 个氧原子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.最高正价:Z >Y >X | B.酸性:H3ZO4>H2YO4>HXO4 |
| C.稳定性:HX<HY<HZ | D.非金属性:Z>Y>X |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 可与Y的应生成单质C,该反应的化学方程式为____________________。
可与Y的应生成单质C,该反应的化学方程式为____________________。 ),W的空间构型为_______________,工业上合成W气体选择的条件是________________。
),W的空间构型为_______________,工业上合成W气体选择的条件是________________。 气体和3mol C的气体单质,一定条件下反应后生成
气体和3mol C的气体单质,一定条件下反应后生成 气体,当反应达到平衡时,单质C的浓度为
气体,当反应达到平衡时,单质C的浓度为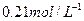 ,则平衡时
,则平衡时 的转化率为________。
的转化率为________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子的失电子能力 X > Y > Z | B.X、Y、Z的单质与水反应是越来越容易 |
| C.原子半径 Z > Y > X | D.原子序数X > Y > Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com