
| ||
| 10.8g |
| 18g/mol |
| ||
| 28g×3.2g |
| 16g |
| 5.6g |
| 28g/mol |
| 8.8g |
| 44g/mol |
| 0.6mol×2 |
| 0.2 |
| 0.6mol+0.2mol+0.2mol×2-0.4mol×2 |
| 0.2 |
| 9.2g |
| 23g/mol |


科目:高中化学 来源: 题型:

| A、把SO2通入紫色石蕊试液,可验证SO2的漂白性 |
| B、构成如图所示装置时,盐桥中的K+向左池移动 |
| C、配制一定物质的量浓度的溶液,定容时俯视容量瓶的刻度线,会使所配溶液浓度偏高 |
| D、将10克ZnSO4?7H2O溶解在90克水中配制10%的ZnSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol?L-1CH3COOH溶液加水稀释,n(H+)增大 |
| B、0.2 mol?L-1盐酸与等体积0.05 mol?L-1Ba(OH)2溶液混合后,溶液pH为1 |
| C、向含等浓度的KCl和KI的混合溶液,滴加少量AgNO3溶液生成黄色沉淀,说明同温度下Ksp(AgCl)大于Ksp(AgI) |
| D、若NH4HCO3溶液、NH4HSO4溶液和NH4NO3溶液中c(NH4+)相等,则c(NH4HSO4)<c(NH4NO3)<c(NH4HCO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
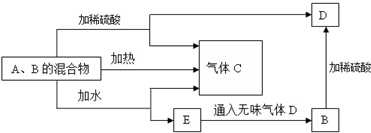
查看答案和解析>>
科目:高中化学 来源: 题型:
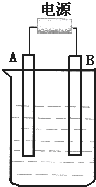 在如图用石墨作电极的电解池中,放入500mLCuSO4溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量.请回答下列问题:
在如图用石墨作电极的电解池中,放入500mLCuSO4溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
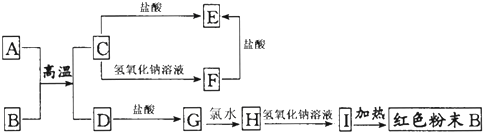
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶质 | NaHCO3 | Na2CO3 | NaCN |
| pH | 8.4 | 11.6 | 11.1 |
| A、溶液中阳离子物质的量之和的关系为:Na2CO3>NaHCO3=NaCN | ||
| B、相同条件下的酸性:H2CO3>HCN | ||
| C、三种溶液中均存在电离平衡和水解平衡 | ||
D、升高Na2CO3溶液的温度会使
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com