
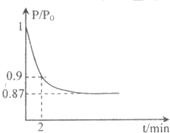
 某实验小组模拟工业合成氨,利用合成的氨气验证氨气具有还原性实验.
某实验小组模拟工业合成氨,利用合成的氨气验证氨气具有还原性实验.| 催化剂 |
| 高温、高压 |
| P |
| P0 |
| 实验步骤 | 现象和结论 |
| △c |
| △t |
| ||
| 2min |
| 实验步骤 | 现象和结论 |
| 取一定质量(ag)的红色固体,加入稀硫酸,反应完毕,洗涤、干燥、称量固体 | ①若固体质量无变化,仍为红色,则只有Cu ②若剩余固体质量为0.444ag,则只有Cu2O ③若剩余固体质量大于0.444ag,则有Cu2O和Cu |
| 实验步骤 | 现象和结论 |
| 取一定质量(ag)的红色固体,加入稀硫酸,反应完毕,洗涤、干燥、称量固体 | ①若固体质量无变化,仍为红色,则只有Cu ②若剩余固体质量为0.444ag,则只有Cu2O ③若剩余固体质量大于0.444ag,则有Cu2O和Cu |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
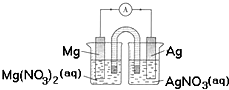
| A、银片为负极,发生的反应为:Ag++e-=Ag |
| B、进行实验时,琼脂中K+移向Mg(NO3)2溶液 |
| C、用稀硫酸代替AgNO3溶液,可形成原电池 |
| D、取出盐桥,电流表依然有偏转 |
查看答案和解析>>
科目:高中化学 来源: 题型:
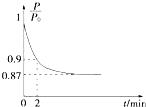 能源的开发利用与人类社会的可持续发展息息相关.
能源的开发利用与人类社会的可持续发展息息相关.| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
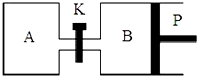 已知X(g)+Y(g)?2Z(g)+W(g)△H=-Q1kJ/mol(Q1>0),在一个有催化剂的固定容积的容器中加入1molX和1molY,在500℃时充分反应,达平衡后Z的浓度为w mol/L,放出热量Q2kJ.
已知X(g)+Y(g)?2Z(g)+W(g)△H=-Q1kJ/mol(Q1>0),在一个有催化剂的固定容积的容器中加入1molX和1molY,在500℃时充分反应,达平衡后Z的浓度为w mol/L,放出热量Q2kJ.查看答案和解析>>
科目:高中化学 来源: 题型:
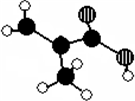 某化工厂生产的某产品只含C、H、O三种元素,其分子模型如下图所示(图中球与球之间的连线代表化学键,如单键、双键等).
某化工厂生产的某产品只含C、H、O三种元素,其分子模型如下图所示(图中球与球之间的连线代表化学键,如单键、双键等).查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com