
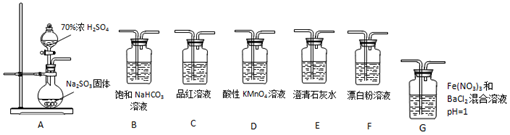
| A. | 80 mL10 mol/L的浓盐酸与足量MnO2反应,转移电子数为0.4 NA | |
| B. | 通入了1 mol Cl2的新制氯水中,HC1O、Cl-、C1O-粒子数之和为2NA | |
| C. | 1 mol Na2O2中含有的阴离子数为2 NA | |
| D. | 标准状况下,4.48L NH3中共用电子对数为0.6 NA |
分析 A.浓盐酸和MnO2在加热条件下发生氧化还原反应生成Cl2,随着反应的进行,浓盐酸浓度逐渐降低,当浓度降低到一定程度后变为稀盐酸,稀盐酸和MnO2不反应;
B.氯气溶于水,一部分与水反应生成氯化氢和次氯酸,一部分以氯气分子存在;
C.过氧化钠中阴离子为过氧根离子;
D.1个氨气分子中含有3对共用电子对.
解答 解:A.80 mL10 mol/L的浓盐酸与足量MnO2反应,随着反应进行盐酸浓度降低变为稀盐酸,不再热反应,所以转移电子数小于0.4 NA,故A错误;
B.通入了1 mol Cl2的新制氯水中,Cl2、HC1O、Cl-、C1O-粒子数之和为2NA,故B错误;
C.过氧化钠中阴离子为过氧根离子,1 mol Na2O2中含有的阴离子数为1NA,故C错误;
D.标准状况下,4.48L NH3中共用电子对数为$\frac{4.48L/mol}{22.4L/mol}$×3×NA=0.6 NA,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的分析应用,明确以物质的量为核心计算公式是解题关键,注意过氧化钠的结构组成,注意浓盐酸与二氧化锰反应条件,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准情况下,22.4LH2O含有的分子数为NA | |
| B. | 1L 0.1 mol?L-1的MgCl2溶液中含Mg2+的数目为0.1NA | |
| C. | 17.6g丙烷中所含的共价键数目为4NA | |
| D. | 20 ml 2mol?L-1 H2O2完全分解,转移的电子数为0.08NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78gNa2O2固体中阴离子的个数为2NA | |
| B. | Na2O2与H2O反应生成1.12L(标准状况)气体,反应中转移的电子数为0.2NA | |
| C. | 1mol氯气溶于足量水中,转移的电子数为NA | |
| D. | 在1 L0.1mol/L碳酸钠溶液中,阴离子总数大于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为10的氧原子:${\;}_{8}^{10}$O | B. | Mg2+的结构示意图: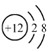 | ||
| C. | 硫化钠的电子式: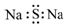 | D. | 氯乙烯的结构简式:C2H3Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,2.24 LC2H4和C2H2的混合气体中含碳原子数目小于0.2 NA | |
| B. | 100 mL 1.0 mol/L FeCl3溶液与足量Cu反应,转移的电子数为0.2 NA | |
| C. | 标况下44.8 mL氯气通入足量水中发生反应,转移电子数为2×10-3NA | |
| D. | 常温下,pH=2的H2SO4溶液中含有的H+数目为0.02 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与铝反应放出氢气的溶液中:Na+、Cl-、S2-、SO32- | |
| B. | c(HCO3-)=0.1mol•L-1的溶液中:Na+、K+、CO32-、Br- | |
| C. | 在由水电离出的c(OH-)=10-18 mol•L-1的溶液中Na+、Mg2+、NO3-、I- | |
| D. | 在能使pH试纸变深蓝色的溶液中:Na+、S2-、CO32-、NO3-、 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 107 g Fe(OH)3胶体中胶体粒子的数目为NA | |
| B. | 2molSO2与1molO2反应生成的SO3分子数为2NA | |
| C. | 14g分子式为CnH2n的链烃中含有的碳碳双键的数目为$\frac{{N}_{A}}{n}$ | |
| D. | 7.8 g Na2O2与足量水反应转移的电子散为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com