
”¾ĢāÄæ”æĄūÓĆĖ®īÜæó£ØÖ÷ŅŖ³É·ÖĪŖCo2O3£¬ŗ¬ÉŁĮæFe2O3”¢A12O3”¢MnO”¢MgO”¢CaO”¢SiO2µČ£©æÉŅŌÖĘČ”¶ąÖֻƹ¤ŹŌ¼Į£¬ŅŌĻĀĪŖ²ŻĖįīܾ§ĢåŗĶĀČ»Æīܾ§ĢåµÄÖʱøĮ÷³Ģ£¬»Ų“šĻĀĮŠĪŹĢā£ŗ

ŅŃÖŖ£ŗ¢Ł½ž³öŅŗÖŠŗ¬ÓŠµÄŃōĄė×ÓÖ÷ŅŖÓŠH+”¢Co2+”¢Fe2+”¢Mn2+”¢Al3+”¢Mg2+”¢Ca2+µČ£®
¢Ś³ĮµķIÖŠÖ»ŗ¬ÓŠĮ½ÖÖ³Įµķ”£
¢ŪĮ÷³ĢÖŠ²æ·ÖŃōĄė×ÓŅŌĒāŃõ»ÆĪļŠĪŹ½³ĮµķŹ±ČÜŅŗµÄpH¼ūĻĀ±ķ£®
³ĮµķĪļ | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
æŖŹ¼³Įµķ | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
ĶźČ«³Įµķ | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
£Ø1£©½ž³ö¹ż³ĢÖŠCo2O3·¢Éś·“Ó¦µÄĄė×Ó·“Ó¦·½³ĢŹ½ĪŖ___________”£
£Ø2£©NaClO3ŌŚ½ž³öŅŗÖŠ·¢ÉśµÄĄė×Ó·“Ó¦·½³ĢŹ½ĪŖ_________________”£
£Ø3£©¼ÓČėNa2CO3µ÷PHÖĮ5.2£¬ÄæµÄŹĒ__________________________£»ŻĶČ”¼Į²ćŗ¬ĆĢŌŖĖŲ£¬Ōņ³ĮµķIIµÄÖ÷ŅŖ³É·ÖĪŖ_____________”£
£Ø4£©²Ł×÷I°üĄØ£ŗ½«Ė®²ć¼ÓČėÅØŃĪĖįµ÷ÕūPHĪŖ2~3£¬___________”¢____________”¢¹żĀĖ”¢Ļ“µÓ”¢¼õŃ¹ŗęøÉµČ¹ż³Ģ”£
£Ø5£©ĪŖ²ā¶Ø“Ö²śĘ·ÖŠCoCl2”¤6H2Oŗ¬Į棬³ĘČ”Ņ»¶ØÖŹĮæµÄ“Ö²śĘ·ČÜÓŚĖ®£¬¼ÓČė×ćĮæĻõĖįĖį»ÆµÄĻõĖįŅųČÜŅŗ£¬¹żĀĖ”¢Ļ“µÓ”¢øÉŌļ£¬²ā³ĮµķÖŹĮ攣Ķعż¼ĘĖć·¢ĻÖ“Ö²śĘ·ÖŠCoCl2”¤6H2OÖŹĮæ·ÖŹż“óÓŚ100%,ĘäŌŅņæÉÄÜŹĒ____________________£Ø»Ų“šŅ»ĢõŌŅņ¼“æÉ£©”£
£Ø6£©½«5.49g²ŻĖįīܾ§Ģå£ØCoC2O4”¤2H2O£©ÖĆÓŚæÕĘųÖŠ¼ÓČČ£¬ŹÜČČ¹ż³ĢÖŠ²»Ķ¬ĪĀ¶Č·¶Ī§ÄŚ·Ö±šµĆµ½Ņ»ÖÖ¹ĢĢåĪļÖŹ£¬ĘäÖŹĮæČēĻĀ±ķ£®
ĪĀ¶Č·¶Ī§/”ę | ¹ĢĢåÖŹĮæ/g |
150”«210 | 4.41 |
290”«320 | 2.41 |
¾²ā¶Ø£¬ÕūøöŹÜČČ¹ż³Ģ£¬Ö»²śÉśĖ®ÕōĘųŗĶCO2ĘųĢ壬Ōņ290”«320”ęĪĀ¶Č·¶Ī§£¬Ź£ÓąµÄ¹ĢĢåĪļÖŹ»ÆѧŹ½ĪŖ__”£
£ŪŅŃÖŖ£ŗ CoC2O4”¤2H2OµÄĦ¶ūÖŹĮæĪŖ183g”¤mol-1£Ż
”¾“š°ø”æ Co2O3+SO32-+4H+= 2Co2++ SO42-+2H2O ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O Ź¹Fe3+ŗĶAl3+³ĮµķĶźČ« CaF2ŗĶMgF2 Õō·¢ÅØĖõ ĄäČ“½į¾§ ²śĘ·ÖŠ½į¾§Ė®ŗ¬ĮæµĶ ²śĘ·ÖŠ»ģÓŠĀČ»ÆÄĘŌÓÖŹ£Ø»Ų“šŅ»Ģõ¼“æÉ£© Co3O4»ņÕßCoO”¤Co2O3
”¾½āĪö”æŗ¬īÜ·ĻĮĻÖŠ¼ÓČėŃĪĖį£¬æɵĆCoCl3”¢FeCl3”¢AlCl3”¢MnCl2”¢MgCl2”¢CaCl2£¬ŠÅĻ¢¢ŁÖŠ½ž³öŅŗŗ¬ÓŠµÄŃōĄė×ÓÖ÷ŅŖÓŠH+”¢Co2+”¢Fe2+”¢Mn2+”¢Al3+”¢Mg2+”¢Ca2+µČ£¬Ōņ½ųČėµÄNa2SO3½«Co3+”¢Fe3+»¹ŌĪŖCo2+”¢Fe2+”£¹¤ŅÕĮ÷³Ģ×īÖÕµĆµ½²ŻĖįīÜ£¬¼ÓČėNaClO3½«Fe2+Ńõ»ÆĪŖFe3+£¬¼ÓČėNa2CO3µ÷pHÖĮ5.2£¬æɵƵ½Fe£ØOH£©3”¢Al£ØOH£©3³Įµķ£¬¹żĀĖŗóĖłµĆĀĖŅŗÖ÷ŅŖŗ¬ÓŠCoCl2”¢MnCl2”¢MgCl2”¢CaCl2£¬ÓĆNaFČÜŅŗ³żČ„øĘ”¢Ć¾£¬¹żĀĖŗó£¬ĻņĀĖŅŗÖŠ¼ÓČėŻĶČ”¼Į£¬½«ĆĢĄė×ÓŻĶČ”£¬ŻĶČ”ŗóµÄÓąŅŗÖŠÖ÷ŅŖŗ¬ÓŠCoCl2£¬½ųČė²ŻĖįļ§ČÜŅŗµĆµ½²ŻĖįīÜ”£
£Ø1£©øł¾ŻŅŌÉĻ·ÖĪöæÉÖŖ½ž³ö¹ż³ĢÖŠCo2O3·¢Éś·“Ó¦µÄĄė×Ó·“Ó¦·½³ĢŹ½ĪŖCo2O3+SO32-+4H+= 2Co2++ SO42-+2H2O£»£Ø2£©NaClO3¾ßÓŠŃõ»ÆŠŌ£¬Äܽ«½ž³öŅŗÖŠµÄFe2+Ńõ»Æ³ÉFe3+£¬×ŌÉķ±»»¹ŌÉś³ÉĀČĄė×Ó£¬Ķ¬Ź±Éś³ÉĖ®£¬Ąė×Ó·“Ó¦·½³ĢŹ½ĪŖClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O£»£Ø3£©øł¾ŻŅŌÉĻ·ÖĪöæÉÖŖ¼ÓČėNa2CO3µ÷pHÖĮ5.2µÄÄæµÄŹĒŹ¹Fe3+ŗĶAl3+³ĮµķĶźČ«£»³ĮµķIIµÄÖ÷ŅŖ³É·ÖĪŖCaF2ŗĶMgF2”££Ø4£©²Ł×÷I°üĄØ£ŗ½«Ė®²ć¼ÓČėÅØŃĪĖįµ÷ÕūpHĪŖ2~3£¬Õō·¢ÅØĖõ”¢ĄäČ“½į¾§”¢¹żĀĖ”¢Ļ“µÓ”¢¼õŃ¹ŗęøÉµČ¹ż³Ģ”££Ø5£©“Ö²śĘ·ÖŠCoCl2”¤6H2OÖŹĮæ·ÖŹż“óÓŚ100%£¬ÕāĖµĆ÷ĀČĄė×Óŗ¬ĮæĘ«øߣ¬Ņņ“ĖĘäŌŅņæÉÄÜŹĒ²śĘ·ÖŠ½į¾§Ė®ŗ¬ĮæµĶ£»²śĘ·ÖŠ»ģÓŠĀČ»ÆÄĘŌÓÖŹ£»£Ø6£©5.49g²ŻĖįīܾ§ĢåµÄĪļÖŹµÄĮæŹĒ0.03mol£¬·Ö½āÉś³ÉĖ®µÄÖŹĮæŹĒ0.06mol”Į18g/mol£½1.08g£¬ĖłŅŌ150”«210”ꏱ½į¾§Ė®ĶźČ«Ź§Č„£¬Ź£Óą¹ĢĢåŹĒCoC2O4£»290”«320”ꏱŹ£Óą¹ĢĢåÖŠCoµÄÖŹĮæŹĒ0.03mol”Į59g/mol£½1.77g£¬ŃõŌ×ÓµÄÖŹĮæŹĒ2.41g£1.77g£½0.64g£¬ĪļÖŹµÄĮæŹĒ0.64g”Ā16g/mol£½0.04mol£¬Ōņ¹ĢĢåÖŠCoŌ×ÓÓėOŌ×ÓĪļÖŹµÄĮæÖ®±ČĪŖ3£ŗ4£¬ĖłŅŌ»ÆѧŹ½ĪŖCo3O4»ņÕßCoO”¤Co2O3”£


 øßÖŠ±ŲĖ¢ĢāĻµĮŠ“š°ø
øßÖŠ±ŲĖ¢ĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŹµŃéŹŅĄūÓĆČēĶ¼×°ÖĆ½ųŠŠÖŠŗĶČČµÄ²ā¶Ø£¬Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ

£Ø1£©×ö1“ĪĶźÕūµÄÖŠŗĶČČ²ā¶ØŹµŃ飬ĪĀ¶Č¼ĘÖĮÉŁŠčŹ¹ÓĆ “Ī£¬Ä³Ķ¬Ń§ĪŖĮĖŹ”Č„ĒåĻ“ĪĀ¶Č¼ĘµÄĀé·³£¬½ØŅ鏵Ń鏱Ź¹ÓĆĮ½Ö§ĪĀ¶Č¼Ę·Ö±š²āĮæĖįŗĶ¼īµÄĪĀ¶Č£¬ÄćŹĒ·ńĶ¬ŅāøĆĶ¬Ń§µÄ¹Ūµć£¬ĪŖŹ²Ć“£æ
ӣ
£Ø2£©ŹµŃéŹŅÓĆ50 mL 0.50 mol”¤L£1ŃĪĖį£¬50 mL 0.55 mol”¤L£1 NaOHČÜŅŗ½ųŠŠ²ā¶ØÖŠŗĶČȵďµŃ飬ĪŖĮĖ°Ń²āĮæŹż¾Ż¼ĒĀ¼ĻĀĄ“£¬ĒėÄćÉč¼Ę±ķøń”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æCH4·Ö×ÓÖŠµÄ4øöH±»±½»łČ”“śŗóµÄ·Ö×Ó½į¹¹ČēÓŅĶ¼ĖłŹ¾£¬Ōņ¹ŲÓŚøĆÓŠ»śĪļµÄĻĀĮŠĖµ·ØÕżČ·µÄŹĒ(””””)

A. øĆÓŠ»śĪļ·Ö×ÓŹ½ĪŖC25H24
B. øƶą»··¼ĢžŹōÓŚ³ķ»··¼Ģž
C. øĆ·Ö×ÓÖŠĖłÓŠĢ¼Ō×Ó²»æÉÄÜ“¦ÓŚĶ¬Ņ»Ę½Ćę
D. øĆÓŠ»śĪļÄÜŹ¹ĖįŠŌøßĆĢĖį¼ŲČÜŅŗĶŹÉ«
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠø÷×éĄė×ÓŌŚÖø¶ØČÜŅŗÖŠŅ»¶ØÄÜ“óĮæ¹²“ęµÄŹĒ(””””)
¢ŁpH£½0µÄČÜŅŗ£ŗNa£«”¢Cl£”¢MnO![]() ”¢SO
ӢSO![]()
¢ŚpH£½11µÄČÜŅŗÖŠ£ŗCO![]() ”¢Na£«”¢AlO
”¢Na£«”¢AlO![]() ”¢NO
”¢NO![]() ”¢S2£”¢SO
”¢S2£”¢SO![]()
¢ŪĖ®µēĄėµÄH£«ÅضČc(H£«)£½10£12 mol”¤L£1µÄČÜŅŗÖŠ£ŗCl£”¢CO![]() ”¢NO
ӢNO![]() ӢNH
ӢNH![]() ӢSO
ӢSO![]()
¢Ü¼ÓČėMgÄܷųöH2µÄČÜŅŗÖŠ£ŗMg2£«”¢NH![]() ”¢Cl£”¢K£«”¢SO
”¢Cl£”¢K£«”¢SO![]()
¢ŻŹ¹ŹÆČļ±äŗģµÄČÜŅŗÖŠ£ŗFe2£«”¢MnO![]() ”¢NO
”¢NO![]() ”¢Na£«”¢SO
”¢Na£«”¢SO![]()
¢ŽÖŠŠŌČÜŅŗÖŠ£ŗFe3£«”¢Al3£«”¢NO![]() ”¢I£”¢Cl£”¢S2£
”¢I£”¢Cl£”¢S2£
A. ¢Ś¢Ü B. ¢Ł¢Ū¢Ž
C. ¢Ł¢Ś¢Ż D. ¢Ł¢Ś¢Ü
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚČżøöĆܱÕČŻĘ÷ÖŠ·Ö±š³äČėCO”¢CH4”¢O2ČżÖÖĘųĢ壬µ±ĖüĆĒµÄĪĀ¶ČŗĶĆܶȶ¼ĻąĶ¬Ź±£¬ÕāČżÖÖĘųĢåµÄŃ¹Ēæ(p)“ӓ󵽊”µÄĖ³ŠņŹĒ(””””)
A. p(CO)>p(CH4)>p(O2) B. p(O2)>p(CO)>p(CH4)
C. p(CH4)>p(O2)>p(CO) D. p(CH4)>p(CO)>p(O2)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓŠŅ»Ņ½Ņ©ÖŠ¼äĢåµÄ½į¹¹¼ņŹ½ČēĻĀ£ŗ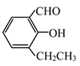
£Ø1£©Ęä·Ö×ÓŹ½ĪŖ______ £¬ŗ¬ÓŠµÄŗ¬Ģ¼¹ŁÄÜĶÅĆū³ĘĪŖ______.
£Ø2£©¹ŲÓŚĘä»ÆѧŠŌÖŹµÄĆčŹö£¬ĻĀĮŠ²»ÕżČ·µÄŹĒ£Ø_____£©.
A. ÄÜÓėĀČ»ÆĢśČÜŅŗ·¢Éś»Æѧ·“Ó¦ B. ÄÜ·¢ÉśŅų¾µ·“Ó¦
C. ÄÜŹ¹äåĖ®ĶŹÉ« D. ÄÜ·¢ÉśĻūČ„·“Ó¦
£Ø3£©Ņ»¶ØĢõ¼žĻĀ£¬1moløĆĪļÖŹ×ī¶ąæÉÓė____ molH2·¢Éś¼Ó³É·“Ó¦.
£Ø4£©Ķ¬Ź±·ūŗĻĻĀĮŠĢõ¼žµÄĶ¬·ÖŅģ¹¹ĢåÓŠ____ ÖÖ.
¢Ł±½»·ÉĻÖ»ÓŠĮ½øöČ”“ś»ł£» ¢ŚÄÜÓėĢ¼ĖįĒāÄĘČÜŅŗ·“Ó¦
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĆŗµÄĘų»ÆµĆCOŗĶH2£¬ŌŚ“߻ƼĮ“ęŌŚĢõ¼žĻĀ½ųŅ»²½ŗĻ³É¼×“¼£Ø·“Ó¦I£©£¬²¢Ķ¬Ź±·¢Éś·“ Ó¦II.
I.CO(g)+2H2(g) ![]() CH3OH(g) ”÷H1 = -81 kJ mol-1
CH3OH(g) ”÷H1 = -81 kJ mol-1
II. CO(g)+H2(g) ![]() C(s)+H2O (g) ”÷H2
C(s)+H2O (g) ”÷H2
ŅŃÖŖ£ŗ¢Ł2C(s)+O2(g)=2CO(g) ”÷H3 =-221 kJ mol-1
¢Ś H2O(g)=H2O(1) ”÷H4 =-44.0 kJ mol-1
¢ŪH2µÄ±ź×¼Č¼ÉÕČČĪŖ285. 8 kJ mol-1
¢Ü·“Ó¦¹ż³ĢÖŠ“߻ƼĮ¶ŌŃ”ŌńŠŌ»į²śÉśÓ°Ļģ£¬¼×“¼Ń”ŌńŠŌŹĒÖø×Ŗ»ÆµÄCOÖŠÉś³É¼×“¼µÄ°Ł·Ö±Č”£
Ēė»Ų“š£ŗ
£Ø1£©·“Ó¦ II ÖŠ”÷H2 =______ kJ mol-1
£Ø2£©ĪŖ¼õČõø±·“Ó¦IIµÄ·¢Éś£¬ĻĀĮŠ²ÉČ”µÄ“ėŹ©ŗĻĄķµÄŹĒ_________”£
A.·“Ó¦Ē°¼ÓČėÉŁĮæµÄĖ®ÕōĘų B.ŌöŃ¹
C.½µµĶ·“Ó¦ĪĀ¶Č D.Ź¹ÓĆŗĻŹŹ“߻ƼĮ£¬Ę½ŗāĒ°Ģįø߼ד¼µÄŃ”ŌńŠŌ
£Ø3£©ŌŚ³£Ń¹ĻĀ£¬COŗĶH2µÄĘšŹ¼¼ÓČėĮæĪŖ10 mol”¢14 mol£¬ČŻĘ÷Ģå»żĪŖ10 L.Ń”ÓĆCu/NiO“߻ƼĮ£¬ÉżøßĪĀ¶ČŌŚ450”ꏱ²āµĆ¼×“¼µÄŃ”ŌńŠŌĪŖ80%£¬COµÄ×Ŗ»ÆĀŹÓėĪĀ¶ČµÄ¹ŲĻµČēĶ¼ĖłŹ¾£¬Ōņ“ĖĪĀ¶ČĻĀ·“Ó¦IµÄĘ½ŗā³£ŹżK=_______£¬²¢ĖµĆ÷COµÄ×Ŗ»ÆĀŹĖęĪĀ¶ČÉżøßĻČŌö“óŗó¼õŠ”µÄŌŅņ£ŗ____________”£

£Ø4£©350”ꏱ¼×“¼µÄŃ”ŌńŠŌĪŖ90%£¬ĘäĖūĢõ¼ž²»±ä£¬»³ö350”ꏱ¼×“¼µÄĪļÖŹµÄĮæĖꏱ¼äµÄ±ä»ÆĒśĻß”£_________________
£Ø5£©¼×“¼Č¼ĮĻµē³ŲÓɼד¼µē¼«”¢Ńõµē¼«ŗĶÖŹ×Ó½»»»Ä¤¹¹³É£¬Š“³öøŗ¼«µÄµē¼«·“Ó¦Ź½£ŗ_________”£ŹµŃéÖ¤Ć÷COŌŚĖįŠŌ½éÖŹÖŠæɵē½ā²śÉś¼×“¼£¬Š“³öŅõ¼«µÄµē¼«·“Ó¦Ź½:__________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æCaC2¾§ĢåµÄ¾§°ū½į¹¹ÓėNaCl¾§ĢåµÄĻąĖĘ(ČēĶ¼ĖłŹ¾)£¬µ«CaC2¾§ĢåÖŠŗ¬ÓŠµÄŃĘĮåŠĪ![]() µÄ“ęŌŚ£¬Ź¹¾§°ūŃŲŅ»øö·½ĻņĄ³¤”£ĻĀĮŠ¹ŲÓŚCaC2¾§ĢåµÄĖµ·ØÖŠÕżČ·µÄŹĒ£Ø £©
µÄ“ęŌŚ£¬Ź¹¾§°ūŃŲŅ»øö·½ĻņĄ³¤”£ĻĀĮŠ¹ŲÓŚCaC2¾§ĢåµÄĖµ·ØÖŠÕżČ·µÄŹĒ£Ø £©
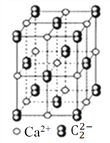
A. 1øöCa2+ÖÜĪ§¾ąĄė×ī½üĒŅµČ¾ąĄėµÄ![]() ŹżÄæĪŖ6
ŹżÄæĪŖ6
B. øĆ¾§ĢåÖŠµÄŅõĄė×ÓÓėF2ŹĒµČµē×ÓĢå
C. 6.4æĖCaC2¾§ĢåÖŠŗ¬ŅõĄė×Ó0.lmol
D. ÓėĆæøöCa2+¾ąĄėĻąµČĒŅ×ī½üµÄCa2+¹²ÓŠ12øö
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŗ£Ė®ŹĒ¾Ž“óµÄ׏Ō“±¦æā”£ĻĀĶ¼ŹĒ“Óŗ£Ė®ÖŠĢįČ”Ź³ŃĪŗĶäåµÄÖ÷ŅŖĮ÷³Ģ”£

£Ø1£©“ÖŃĪ³żŗ¬ NaCl Ķā£¬»¹ŗ¬ÓŠÉŁĮæ MgCl2”¢ CaCl2”¢ Na2SO4ŅŌ¼°ÄąÉ³µČŌÓÖŹ”£ŅŌĻĀŹĒ“ÖŃĪĢį“æµÄ
²Ł×÷Į÷³Ģ”£

Ģį¹©µÄŹŌ¼Į£ŗ
Na2CO3ČÜŅŗ”¢ K2CO3ČÜŅŗ”¢ NaOH ČÜŅŗ”¢ BaCl2ČÜŅŗ”¢ Ba(NO3)2ČÜŅŗ”¢±„ŗĶ NaCl ČÜŅŗ”£
¢Ł³żČ„ČÜŅŗ I ÖŠµÄ MgCl2”¢ CaCl2”¢ Na2SO4£¬“ÓĢį¹©µÄŹŌ¼ĮÖŠŃ”³ö a Ėł“ś±ķµÄŹŌ¼Į£¬°“µĪ¼ÓĖ³ŠņŅĄ“ĪĪŖ£ŗ ¹żĮæµÄNaOH ČÜŅŗ”¢_______”¢_______£»
¢ŚČēŗĪÖ¤Ć÷²Ł×÷¢ŁÖŠ NaOH ČÜŅŗŅŃ¾¹żĮæ£æ_______”£
¢ŪÕō·¢¹ż³ĢĖłÓƵÄÖ÷ŅŖŅĒĘ÷ÓŠ£ŗĢś¼ÜĢØ”¢¾Ę¾«µĘ”¢_______£»
£Ø2£©Ä³Ķ¬Ń§ŌŚŹµŃéŹŅÖŠÓĆĖÄĀČ»ÆĢ¼ŻĶČ”½ĻøßÅØ¶ČµÄäåĖ®ÖŠµÄä壬¾Õńµ“²¢ŌŚĢś¼ÜĢØÉĻ¾²ÖĆ·Ö²ćŗó£¬
¢Ł·ÖĄė³öĖÄĀČ»ÆĢ¼²ćµÄ²Ł×÷ŹĒ£ŗ_______”£
¢Ś·ÖĄėäåµÄĖÄĀČ»ÆĢ¼ČÜŅŗµÄ²Ł×÷·½·ØŹĒ£ŗ_______”£
£Ø3£©¹¤ŅµÉĻ½«½ĻøßÅØ¶ČµÄäåĖ®¾½ųŅ»²½“¦ĄķµĆµ½¹¤Ņµäå”£Ä³ŃŠ¾æŠŌѧĻ°Š”×éĪŖĮĖ½ā“Ó¹¤ŅµäåÖŠĢį“æäåµÄ·½·Ø£¬²éŌÄĮĖÓŠ¹Ų׏ĮĻ£¬ Br2µÄ·ŠµćĪŖ 59”ę£¬Ī¢ČÜÓŚĖ®£¬ÓŠ¶¾ŠŌŗĶĒæøÆŹ“ŠŌ”£Ė®µÄ·ŠµćĪŖ 100”ę”£ĖūĆĒ²Ī¹ŪÉś²ś¹ż³Ģŗó£¬Éč¼ĘĮĖČēĻĀ×°ÖĆ¼ņĶ¼£ŗ

¢ŁĶ¼ÖŠŅĒĘ÷ B µÄĆū³Ę£ŗ_______”£
¢ŚÓĆČČĖ®Ō”¼ÓČȵÄÓŵćŹĒ£ŗ_______”£
¢ŪŹµŃé×°ÖĆĘųĆÜŠŌĮ¼ŗĆ£¬ŅŖ“ļµ½Ģį“æäåµÄÄæµÄ£¬ŹÕ¼ÆäåŹ±ĪĀ¶Č¼ĘÓ¦æŲÖʵÄĪĀ¶ČĪŖ£ŗ_______”ę”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com