
| A. | 软脂酸(C15H31COOH) | B. | 油酸(C17H33COOH) | ||
| C. | 草酸(HOOC-COOH) | D. | 氨基酸(H2N-CH2COOH) |
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:选择题

| A. | 晶体中碳原子键全部是碳碳单键 | |
| B. | 石墨烯与金刚石都是碳的同素异形体 | |
| C. | 石墨烯中所有碳原子可以处于同一个平面 | |
| D. | 从石墨中剥离得到石墨烯需克服分子间作用力 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | n(FeO):n(Fe3O4)=1:1 | B. | n(Fe2O3):n(FeO)=2:1 | ||
| C. | n(Fe2O3):n(FeO)=1:2 | D. | n(Fe2O3):n(Fe3O4)=1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
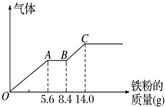 硝酸铜是重要的化工原料,以下三种方法均可得到硝酸铜.
硝酸铜是重要的化工原料,以下三种方法均可得到硝酸铜.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol氢气完全燃烧生成液态水放出的热量小于241.8KJ | |
| B. | 1mol水蒸气完全分解成氢气与氧气,需吸收241.8kJ热量 | |
| C. | 2mol氢气与1mol氧气的总能量小于2mol 水蒸气的总能量 | |
| D. | 2mol氢氢键和1mol氧氧键拆开所消耗的能量大于4mol氢氧键成键所放出的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | TiCl4既是氧化产物又是还原产物 | |
| B. | 氧化剂与还原剂的物质的量之比为1:1 | |
| C. | 当转移电子数目为0.2NA时,气体体积增大1.12L | |
| D. | 当有26g固体参加反应时,转移电子数目为NA. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酒精清洗做过碘升华的烧杯 | |
| B. | 用水清洗做过银镜反应的试管 | |
| C. | 用浓盐酸清洗做过高锰酸钾分解实验的试管 | |
| D. | 用氢氧化钠溶液清洗盛过苯酚的试管 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
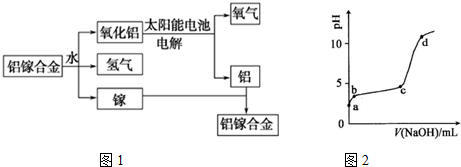
 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com