
 CO(g)+3H2(g) ØSH1="+206.1" kJ/mol
CO(g)+3H2(g) ØSH1="+206.1" kJ/mol 2CO(g)+2H2(g) ØSH2="+247.3" kJ/mol
2CO(g)+2H2(g) ØSH2="+247.3" kJ/mol  CO2(g)+ H2(g) ØSH3
CO2(g)+ H2(g) ØSH3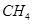 µÄĪļÖŹµÄĮæÅضČĖę·“Ó¦Ź±¼äµÄ±ä»ÆČēĶ¼1ĖłŹ¾”£10minŹ±£¬øıäµÄĶā½ēĢõ¼žæÉÄÜŹĒ ”£
µÄĪļÖŹµÄĮæÅضČĖę·“Ó¦Ź±¼äµÄ±ä»ÆČēĶ¼1ĖłŹ¾”£10minŹ±£¬øıäµÄĶā½ēĢõ¼žæÉÄÜŹĒ ”£
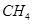 ŗĶ
ŗĶ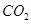 £¬Ź¹¼×”¢ŅŅĮ½ČŻĘ÷³õŹ¼ČŻ»żĻąµČ”£ŌŚĻąĶ¬ĪĀ¶ČĻĀ·¢Éś·“Ó¦¢Ś£¬²¢Ī¬³Ö·“Ó¦¹ż³ĢÖŠĪĀ¶Č²»±ä”£ŅŃÖŖ¼×ČŻĘ÷ÖŠ
£¬Ź¹¼×”¢ŅŅĮ½ČŻĘ÷³õŹ¼ČŻ»żĻąµČ”£ŌŚĻąĶ¬ĪĀ¶ČĻĀ·¢Éś·“Ó¦¢Ś£¬²¢Ī¬³Ö·“Ó¦¹ż³ĢÖŠĪĀ¶Č²»±ä”£ŅŃÖŖ¼×ČŻĘ÷ÖŠ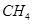 µÄ×Ŗ»ÆĀŹĖꏱ¼ä±ä»ÆµÄĶ¼ĻńČēĶ¼3ĖłŹ¾£¬ĒėŌŚĶ¼3ÖŠ»³öŅŅČŻĘ÷ÖŠ
µÄ×Ŗ»ÆĀŹĖꏱ¼ä±ä»ÆµÄĶ¼ĻńČēĶ¼3ĖłŹ¾£¬ĒėŌŚĶ¼3ÖŠ»³öŅŅČŻĘ÷ÖŠ µÄ×Ŗ»ÆĀŹĖꏱ¼ä±ä»ÆµÄĶ¼Ļń”£
µÄ×Ŗ»ÆĀŹĖꏱ¼ä±ä»ÆµÄĶ¼Ļń”£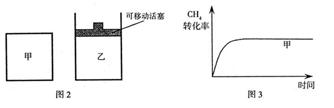
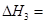 ”£800”ꏱ£¬·“Ó¦¢ŪµÄ»ÆŃ§Ę½ŗā³£ŹżK=1.0£¬Ä³Ź±æĢ²āµĆøĆĪĀ¶ČĻĀµÄĆܱÕČŻĘ÷ÖŠø÷ĪļÖŹµÄĪļÖŹµÄĮæ¼ūĻĀ±ķ£ŗ
”£800”ꏱ£¬·“Ó¦¢ŪµÄ»ÆŃ§Ę½ŗā³£ŹżK=1.0£¬Ä³Ź±æĢ²āµĆøĆĪĀ¶ČĻĀµÄĆܱÕČŻĘ÷ÖŠø÷ĪļÖŹµÄĪļÖŹµÄĮæ¼ūĻĀ±ķ£ŗ
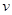 (Õż)
(Õż)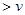 (Äę) b£®
(Äę) b£®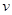 (Õż)<
(Õż)<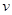 (Äę) c£®
(Äę) c£®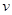 (Õż)=
(Õż)= (Äę) d£®ĪŽ·ØÅŠ¶Ļ
(Äę) d£®ĪŽ·ØÅŠ¶Ļ 2SO3(g)£»”÷H=£96.56 kJ?mol-1£¬¼×ČŻĘ÷ŌŚ·“Ó¦¹ż³ĢÖŠ±£³ÖŃ¹Ēæ²»±ä£¬ŅŅČŻĘ÷±£³ÖĢå»ż²»±ä£¬±ūČŻĘ÷Ī¬³Ö¾ųČČ£¬ČżČŻĘ÷ø÷×Ō½ØĮ¢»ÆŃ§Ę½ŗā”£
2SO3(g)£»”÷H=£96.56 kJ?mol-1£¬¼×ČŻĘ÷ŌŚ·“Ó¦¹ż³ĢÖŠ±£³ÖŃ¹Ēæ²»±ä£¬ŅŅČŻĘ÷±£³ÖĢå»ż²»±ä£¬±ūČŻĘ÷Ī¬³Ö¾ųČČ£¬ČżČŻĘ÷ø÷×Ō½ØĮ¢»ÆŃ§Ę½ŗā”£
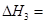 ØSH2-ØSH1=£Ø206.1-247.3£©=”Ŗ41.2 kJ/mol£»
ØSH2-ØSH1=£Ø206.1-247.3£©=”Ŗ41.2 kJ/mol£»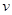 (Õż)
(Õż)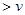 (Äę)£»
(Äę)£»


| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
| »Æѧ·½³ĢŹ½ | K (T1 ) | K (T2) |
F2+H2 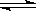 2HF 2HF | 1.8 ”Į1036 | 1.9 ”Į1032 |
Cl2+H2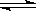 2HCl 2HCl | 9.7 ”Į1012 | 4.2 ”Į1011 |
Br2+H2  2HBr 2HBr | 5.6 ”Į107 | 9.3 ”Į106 |
I2+H2 2HI 2HI | 43 | 34 |

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®ČĪŗĪæÉÄę·“Ó¦¶¼ÓŠŅ»¶ØµÄĻŽ¶Č |
| B£®»Æѧ·“Ó¦“ļµ½ĻŽ¶ČŹ±£¬ÕżÄę·“Ó¦ĖŁĀŹĻąµČ |
| C£®»Æѧ·“Ó¦µÄĻŽ¶ČæÉŅŌĶعżøıäĢõ¼ž¶ųøıä |
| D£®µ±Ņ»øö»Æѧ·“Ó¦ŌŚŅ»¶ØĢõ¼žĻĀ“ļµ½ĻŽ¶ČŹ±£¬·“Ó¦¼“Ķ£Ö¹ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
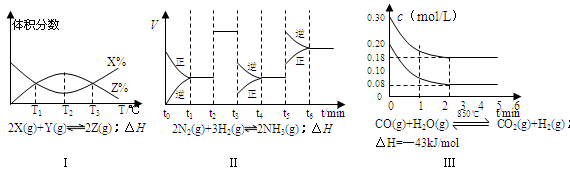
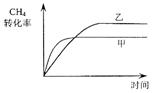
| A£®ÓÉĶ¼¢ńÖŖ£¬·“Ó¦ŌŚT1”¢T3“¦“ļµ½Ę½ŗā£¬ĒŅøĆ·“Ó¦µÄ”÷H£¼0 |
| B£®ÓÉĶ¼¢ņÖŖ£¬·“Ó¦ŌŚt6Ź±£¬NH3Ģå»ż·ÖŹż×ī“ó |
| C£®ÓÉĶ¼¢ņÖŖ£¬t3Ź±²ÉČ”½µµĶ·“Ó¦ĪĀ¶ČµÄ“ėŹ© |
| D£®Ķ¼¢óŌŚ10LČŻĘ÷”¢850”ꏱ·“Ó¦£¬ÓÉĶ¼ÖŖ£¬µ½4minŹ±£¬·“Ó¦·Å³ö51.6kJµÄČČĮæ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
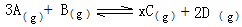
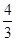 mol£¬ŅŖŹ¹Ę½ŗāŹ±ø÷ĪļÖŹµÄ°Ł·Öŗ¬ĮæÓėÉĻŹöĘ½ŗāĻąĶ¬£¬Ōņ»¹ŅŖ¼ÓČė______mol______ ĪļÖŹ.
mol£¬ŅŖŹ¹Ę½ŗāŹ±ø÷ĪļÖŹµÄ°Ł·Öŗ¬ĮæÓėÉĻŹöĘ½ŗāĻąĶ¬£¬Ōņ»¹ŅŖ¼ÓČė______mol______ ĪļÖŹ.²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
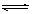 2C(g)Čō“ļµ½Ę½ŗāµÄ±źÖ¾ŹĒ
2C(g)Čō“ļµ½Ę½ŗāµÄ±źÖ¾ŹĒ ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
 PCl3£Øg£©+Cl2£Øg£©£»”÷H1>0 K1=1mol”¤L”Ŗ1
PCl3£Øg£©+Cl2£Øg£©£»”÷H1>0 K1=1mol”¤L”Ŗ1 COCl2£Øg£©£»”÷H2<0 K2=5”Į104L”¤mol”Ŗ1
COCl2£Øg£©£»”÷H2<0 K2=5”Į104L”¤mol”Ŗ1 CO£Øg£©+Cl2£Øg£©”÷H3 K3
CO£Øg£©+Cl2£Øg£©”÷H3 K3 2SO3£Øg£©£»”÷H4<0
2SO3£Øg£©£»”÷H4<0²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
 bM£Øg£©£¬M”¢NµÄĪļÖŹµÄĮæĖꏱ¼äµÄ±ä»ÆĒśĻßČēĶ¼ĖłŹ¾£ŗ
bM£Øg£©£¬M”¢NµÄĪļÖŹµÄĮæĖꏱ¼äµÄ±ä»ÆĒśĻßČēĶ¼ĖłŹ¾£ŗ
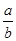 =__________
=__________ | A£®·“Ó¦ÖŠMÓėNµÄĪļÖŹµÄĮæÖ®±ČĪŖ1©U1 |
| B£®»ģŗĻĘųĢåµÄ×ÜÖŹĮæ²»Ėꏱ¼äµÄ±ä»Æ¶ų±ä»Æ |
| C£®»ģŗĻĘųĢåµÄ×ÜĪļÖŹµÄĮæ²»Ėꏱ¼äµÄ±ä»Æ¶ų±ä»Æ |
| D£®µ„Ī»Ź±¼äÄŚĆæĻūŗÄa mol N£¬Ķ¬Ź±Éś³Éb mol M |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
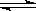 2C(Ęų)+2D(¹Ģ)“ļµ½Ę½ŗāµÄ±źÖ¾µÄŹĒ ( )
2C(Ęų)+2D(¹Ģ)“ļµ½Ę½ŗāµÄ±źÖ¾µÄŹĒ ( )²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com