
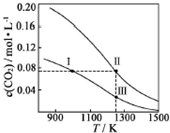
 在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1mol CO2和0.2mol CO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1mol CO2和0.2mol CO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )| A. | 化学平衡常数K:K(状态Ⅰ)<K(状态Ⅱ)<K(状态Ⅲ) | |
| B. | CO2的平衡转化率α:α(状态Ⅰ)<α(状态Ⅱ)=α(状态Ⅲ) | |
| C. | 体系中c(CO):c (CO,状态Ⅱ)<2c (CO,状态Ⅲ) | |
| D. | 逆反应速率v逆:v逆(状态Ⅰ)>v逆(状态Ⅲ) |
分析 A.状态II、状态Ⅲ的温度相同,状态II看作先加入0.1molCO2,与状态Ⅲ平衡时CO的浓度相同,再加入0.1molCO2,若平衡不移动,Ⅱ状态CO的浓度等于2倍Ⅲ,但再充入CO2,相当增大压强,平衡左移动,消耗CO;
B.由图象可知,状态Ⅱ和状态Ⅲ平衡时CO2的浓度不同;
C.状态II、状态Ⅲ的温度相同,状态II看作先加入0.1molCO2,与状态Ⅲ平衡时CO的浓度相同,再加入0.1molCO2,若平衡不移动,Ⅱ状态CO的浓度等于2倍Ⅲ,但再充入CO2,相当增大压强,平衡左移动,消耗CO;
D.状态I、状态Ⅲ的温度不同,温度高反应速率快.
解答 解:A.状态II、状态Ⅲ的温度相同,所以KⅡ=KⅢ,又由图中温度高平衡时c(CO2)小,则升高温度平衡正向移动,则温度高K大,所以KⅠ<KⅡ=KⅢ,故A错误;
B.由图象可知,状态Ⅱ和状态Ⅲ平衡时CO2的浓度不同,所以转化率不同,故B错误;
C.状态II、状态Ⅲ的温度相同,状态II看作先加入0.1molCO2,与状态Ⅲ平衡时CO的浓度相同,再加入0.1molCO2,若平衡不移动,Ⅱ状态CO的浓度等于2倍Ⅲ,但再充入CO2,相当增大压强,平衡左移,消耗CO,则c(CO,状态Ⅱ)<2c(CO,状态Ⅲ),故C正确;
D.状态I、状态Ⅲ的温度不同,温度高反应速率快,则逆反应速率为V逆(状态Ⅰ)<V逆(状态Ⅲ),故D错误;
故选C.
点评 本题考查化学平衡及平衡的建立,为高频考点,把握平衡移动的影响因素、图象分析为解答的关键,选项B为解答的难点,题目难度中等.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:选择题
| A. | “煤改气”、“煤改电”等改造工程有利于减少雾霾天气 | |
| B. | PM2.5含有的铅、镉、铬、钒、砷等元素均为对人体有害的金属元素 | |
| C. | 田间焚烧秸秆易造成灰霾,灰霾粒子平均直径在1000~2000nm之间,能发生丁达尔效应 | |
| D. | 汽车尾气净化装置可将尾气中的NO和CO等有害气体转化为N2和CO2,该装置中的催化剂可降低NO和CO反应的活化能,有利于提高该反应的平衡转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH2-OH | B. | CH3-CH2-CH2-OH | ||
| C. | HO-CH2-CH2-CH2-OH | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可能呈酸性 | B. | 可能呈中性 | C. | 一定呈碱性 | D. | 一定呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
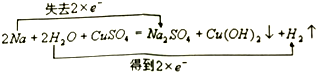 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
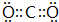 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
| 500 | 700 | 800 | |||
| ①2H2(g)+CO(g)?CH3OH(g) | △H1 | K1 | 2.5 | 0.34 | 0.15 |
| ②CO2(g)+H2(g)?CO(g)+H2(g) | △H2 | K2 | 1.0 | 1.70 | 2.52 |
| ③CO2(g)+3H2(g)?CH3OH(g)+H2(g) | △H3 | K3 | |||
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molCO 2mol H2 | 1mol CH3OH | 2mol CH3OH | |
| 平衡时数据 | CH3OH的浓度(mol/L) | C1 | C2 | C3 |
| 反应体系的能量变化 | aKJ | bKJ | cKJ | |
| 体系压强(Pa) | P1 | P2 | P3 | |
| 反应物转化率 | a1 | a2 | a3 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com