
【题目】二氧化碳是导致温室效应的主要气体,其对应的水溶液碳酸是可乐饮料的主要成分之一。回答下列问题:
(1)下列事实中,能证明碳酸是弱酸的是________
A.碳酸不稳定,易分解为二氧化碳和水
B.用氢氧化钠溶液中和等浓度的碳酸溶液,需要氢氧化钠溶液的体积是碳酸体积的2倍
C.相同条件下,碳酸的导电能力低于相同浓度的硫酸溶液
D.常温下,5.0×10-6mol/L的碳酸溶液pH值为6
(2)煤的燃烧也是导致温室效应的原因之一,其燃烧有下列两种途径:
途径I:C(s)+O2(g)=CO2(g) ΔH=Q1kJ/mol
途径II:先制水煤气:C(s)+H2O(g)=CO(g)+H2(g) ΔH=Q2kJ/mol
再燃烧水煤气:CO(g)+1/2O2(g)=CO2(g) ΔH=Q3kJ/mol
H2(g)+1/2O2(g)=H2O(g) ΔH=Q4kJ/mol
则Q1、Q2、Q3、Q4的数学关系式是___________________________________;
(3)常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.6,c(H2CO3)=1.5×10-5 mol/L。
①若忽略水的电离及H2CO3的第二级电离,则H2CO3![]() HCO3-+H+的平衡常数K1=_______,该步电离的电离度α=______(已知:10-5.6=2.5×10-6,保留一位小数);
HCO3-+H+的平衡常数K1=_______,该步电离的电离度α=______(已知:10-5.6=2.5×10-6,保留一位小数);
②常温下,0.10 mol/L NaHCO3溶液的pH等于8.0,则此时溶液中c(H2CO3)_____c(CO32-)(填“>”“=”或“<”),原因是__________________________________________________;(用离子方程式和必要的文字说明);
③向饱和碳酸溶液中分别加入下列物质,能使碳酸的第一步电离平衡向右移动的是_________
A.HCl气体 B.NaOH固体 C.Na单质 D.苯酚钠溶液
【答案】 CD Q1=Q2+Q3+Q4(或其它等式) 4.2×10-7 mol·L-1 14.3% > HCO3-![]() CO32-+H+、HCO3-+H2O
CO32-+H+、HCO3-+H2O![]() H2CO3+OH-,HCO3-的水解程度大于电离程度 BCD
H2CO3+OH-,HCO3-的水解程度大于电离程度 BCD
【解析】(1)A说明碳酸不稳定,与酸的强弱没有关系,故A错误;B、酸碱中和反应只能说明碳酸具有酸性,不能说明其酸性强弱,故B错误;C、导电能力取决于溶液中自由离子浓度的大小,相同条件下,碳酸的导电能力低于相同浓度的硫酸溶液,说明碳酸没有完全电离,即存在电离平衡,说明碳酸是弱酸,故C正确;D、常温下,5.0×10-6mol/L的碳酸溶液,若完全电离,则c(H+)=1.0×10-5mol/L,即pH值为5,但实际上溶液pH值为6,说明碳酸没有完全电离,因此碳酸是弱酸。本题正确答案为CD。
(2)途径途径I就是途径II三个反应的加和,所以由盖斯定律可得Q1=Q2+Q3+Q4;
(3) ①若忽略水的电离及H2CO3的第二级电离,则H2CO3![]() HCO3-+H+的平衡常数K1=
HCO3-+H+的平衡常数K1= =
= ![]() 4.2×10-7 mol·L-1;其电离度α=
4.2×10-7 mol·L-1;其电离度α=  ×100% =
×100% = ![]() ×100%=14.3%;②常温下,0.10 mol/L NaHCO3溶液的pH等于8.0,说明HCO3-的水解程度大于其电离程度,所以水解生成的c(H2CO3)大于电离生成的c(CO32-);其离子方程式分别为HCO3-+ H2O
×100%=14.3%;②常温下,0.10 mol/L NaHCO3溶液的pH等于8.0,说明HCO3-的水解程度大于其电离程度,所以水解生成的c(H2CO3)大于电离生成的c(CO32-);其离子方程式分别为HCO3-+ H2O![]() H2CO3+OH-和HCO3-
H2CO3+OH-和HCO3-![]() CO32-+H+;③根据碳酸的第一步电离平衡H2CO3
CO32-+H+;③根据碳酸的第一步电离平衡H2CO3![]() HCO3-+H+,A、通入HCl气体,增大c(H+),平衡向左移动,故A错误;B、加入NaOH固体,中和了H+,使c(H+)减小,平衡向右移动,则B正确;C、Na单质与水反应生成NaOH,同理平衡向右移动,则C正确;D、苯酚钠溶液水解呈碱性,生成的OH—中和了H+,使c(H+)减小,平衡向右移动,故D正确。本题正确答案为BCD。
HCO3-+H+,A、通入HCl气体,增大c(H+),平衡向左移动,故A错误;B、加入NaOH固体,中和了H+,使c(H+)减小,平衡向右移动,则B正确;C、Na单质与水反应生成NaOH,同理平衡向右移动,则C正确;D、苯酚钠溶液水解呈碱性,生成的OH—中和了H+,使c(H+)减小,平衡向右移动,故D正确。本题正确答案为BCD。


科目:高中化学 来源: 题型:
【题目】质子交换膜燃料电池(简称:PEMFC),又称固体高分子电解质燃料电池,是一种以含氢燃料与空气作用产生电力与热力的燃料电池,膜极组和集电板串联组合成一个燃料电池堆。目前,尤以氢燃料电池倍受电源研究开发人员的注目。它的结构紧凑,工作温度低(只有80℃),启动迅速,功率密度高,工作寿命长。工作原理如图,下列说法正确的是

A. 可用一氧化碳代替图中氢气形成质子交换膜燃料电池
B. B极的电极反应式为O2+4H++4e-=2H2O
C. 用该电池作为精炼铜的电源时,A极与粗铜电极相连
D. 当外电路中转移0.1mole-时,通过质子交换膜的H+数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁分别为A、B、C、D四种短周期元素的最高价氧化物对应的水化物,已知0.1mol·L-1甲、丙、丁溶液的pH与A、C、D的原子序数关系如图所示(lg2=0.3),且常温下甲、丙、丁均可与乙反应。下列说法正确的是

A. 原子半径:A<B<C<D
B. A、B分别与D形成的化合物均为离子化合物
C. B、C的简单离子都会影响水的电离平衡
D. 乙在浓氨水中能溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对实验仪器特点的描述正确的或实验能达到预期目的的是( )
A.用10mL量筒去量取5.35mL浓硫酸
B.用托盘天平称量6.25g硝酸钾固体
C.量筒的“0”刻度在下面
D.容量瓶上的标识有温度、容量和刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol/L的盐酸滴定20.00mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸体积关系如右图所示。下列有关叙述错误的是

A. a点溶液呈碱性的原因用离子方程式表示为:CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
B. b点处的溶液中c(Na+)-2c(CO32-)=c(HCO3-)+c(Cl-)
C. 滴定过程中使用酚酞作为指示剂比石蕊更准确
D. d点处溶液中水电离出的c(H+)小于c点处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是一种有机香精的调香剂。实验室由A制备F的一种合成路线如下:
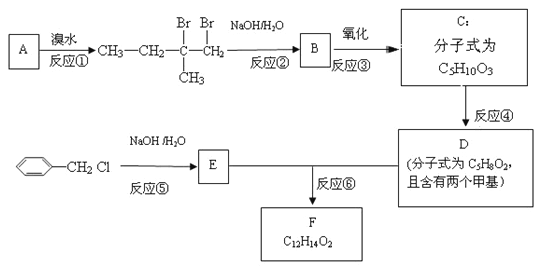
回答下列问题:
(1)化合物A的化学名称是________________________________;
(2)由C生成D和D、E生成F的反应类型分别是_____________、_______________;
(3)C的结构简式为________________________________________________________;
(4)反应⑥的化学方程式为_________________________________________________;
(5)芳香化合物G是E的同分异构体,且G能与金属钠反应放出H2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为3:2:2:1,写出一种符合要求的G的结构简式:_____________
(6)写出用正丙醇(CH3CH2CH2OH)为原料制备化合物CH3COCOOCH2CH2CH3的合成路线_____________________________(其它试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:A+3B![]() 2C+2D在4种不同的情况下的反应速率分别为
2C+2D在4种不同的情况下的反应速率分别为
①v(A )=0.15mol/(L·s) ②v(B )=0.6mol/(L·s) ③v(C )=0.4mol/(L·s) ④v(D )=0.45mol/(L·s)
该反应进行速率最快的是
A. .① B. ②和③ C. ④ D. ①和④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式正确的是( )
A. 将NO2通入水中,红棕色消失:3NO2+H2O=2HNO3+O2
B. 漂白粉实现漂白性:CO2+2ClO-+H2O=CO32-+2HClO
C. Na与水反应产生气体:Na+H2O=Na++OH-+H2↑
D. 燃煤时加入石灰石可减少SO2的排放:2CaCO3+O2+2SO2![]() 2CaSO4+2CO2
2CaSO4+2CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器内,t℃时发生反应:N2(g)+3H2(g)![]() 2NH3(g),在体系中,n(N2)随时间的变化如下表:
2NH3(g),在体系中,n(N2)随时间的变化如下表:
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
N2的物质的量(mol) | 0.20 | 0.10 | 0.08 | 0.06 | 0.06 | 0.06 |
(1)上述反应在第5min时,N2的转化率为_______________________;
(2)用H2表示从0~2 min内该反应的平均速率v(H2)=_____________;
(3)t℃时,在4个均为2L密闭容器中不同投料下进行合成氨反应。根据在相同时间内测定的结果,判断该反应进行快慢的顺序为______________。(用字母填空,下同);
a.v(NH3)=0.05 mol·L-1·min-1 b.v(H2)=0.03 mol·L-1·min-1
c.v(N2)=0.02 mol·L-1·min-1 d.v(H2)=0.00 l mol·L-1·s-1
(4)下列表述能作为反应达到化学平衡状态的标志是_____________。
a.反应速率v(N2):v(H2):v(NH3)=1:3:2
b.各组分的物质的量浓度不再改变
c.混合气体的平均相对分子质量不再改变
d.混合气体的密度不变
e.单位时间内生成n mol N2的同时,生成3n mol H2
f.v(N2)消耗=2v(NH3)消耗
g.单位时间内3mol H—H键断裂的同时2mol N—H键也断裂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com