
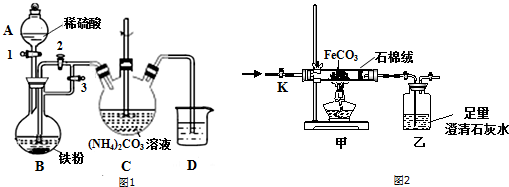
分析 (1)①仪器A为分液漏斗;根据c=$\frac{1000ρω}{M}$计算浓硫酸物质的量浓度,再根据稀释定律计算需要浓硫酸的体积;
②亚铁离子容易被氧气氧化,制备过程中应在无氧环境中进行,Fe与稀硫酸反应制备硫酸亚铁,利用反应生成的氢气排尽装置中的空气,C装置中FeSO4和NH4HCO3发生反应:FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+CO2↑+H2O,利用生成氢气,使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中;
(2)①利用硫酸溶解加热后的固体,再利用酸性高锰酸钾溶液检验是否含有亚铁离子;
②23.2g FeCO3物质的量为$\frac{23.2g}{116g/mol}$=0.2mol,完全分解可以得到二氧化碳为2mol×44g/mol=8.8g,反应中通入氧气,分解得到的FeO会被氧化,计算剩余固体的质量,结合Fe原子守恒计算残留固体中O原子物质的量,可以确定剩余固体的化学式,进而书写反应方程式;
(3)①实验目的是制备乳酸亚铁晶体,加入Fe粉,防止Fe2+离子被氧化,过量的铁粉用乳酸除去,Fe被充分利用,可以抑制亚铁离子水解;
分离过程中加入无水乙醇,减少乳酸亚铁在水中的溶解量,有利于晶体析出;
②维生素作还原剂,防止Fe2+被氧化.
解答 解:(1)①由仪器A的结构特征,可知A为分液漏斗,根据c=$\frac{1000ρω}{M}$可知,浓硫酸物质的量浓度为$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,根据稀释定律,需要浓硫酸的体积为$\frac{100mL×4mol/L}{18.4mol/L}$=21.7mL,
故答案为:分液漏斗;21.7mL;
②亚铁离子容易被氧气氧化,制备过程中应在无氧环境中进行,Fe与稀硫酸反应制备硫酸亚铁,利用反应生成的氢气排尽装置中的空气,C装置中FeSO4和NH4HCO3发生反应:FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+CO2↑+H2O,利用生成氢气,使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中,具体操作为:关闭活塞3,打开活塞2,
故答案为:关闭活塞3,打开活塞2;
(2)①利用硫酸溶解加热后的固体,再滴入酸性高锰酸钾溶液检验,若溶液紫色脱去,说明含有Fe2+,否则不含Fe2+,
故答案为:酸性高锰酸钾溶液;
②23.2g FeCO3物质的量为$\frac{23.2g}{116g/mol}$=0.2mol,完全分解可以得到二氧化碳为2mol×44g/mol=8.8g,反应中通入氧气,分解得到的FeO会被氧化,剩余固体中Fe为0.2mol,则剩余固体中O元素物质的量为$\frac{23.2g-7.2g-0.2mol×56g/mol}{16g/mol}$=0.3mol,故Fe、O物质的量之比为2:3,则剩余固体为Fe2O3,反应方程式为:4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2,
故答案为:Fe2O3;4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2;
(3)①Fe2+离子易被氧化为Fe3+离子,实验目的是制备乳酸亚铁晶体,加入Fe粉,防止Fe2+离子被氧化,过量的铁粉可以充分利用,得到乳酸亚铁,且抑制Fe2+的水解,
分离过程中加入无水乙醇,减少乳酸亚铁在水中的溶解量,有利于晶体析出,
故答案为:除去过量铁粉,且抑制Fe2+的水解;减少乳酸亚铁在水中的溶解量,有利于晶体析出;
②维生素作还原剂,防止Fe2+被氧化,
故答案为:作还原剂,防止Fe2+被氧化.
点评 本题考查实验制备方案,涉及化学仪器识别、对操作的分析评价、物质分离提纯、信息获取与迁移应用、溶液配制、化学计算等,明确原理是解题关键,是对学生综合能力的考查,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,B最外层电子数是2,C的气态氢化物的水溶液呈碱性,据此填空:
,B最外层电子数是2,C的气态氢化物的水溶液呈碱性,据此填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2、I2、HI平衡时的混合气体加压后颜色变深 | |
| B. | Na2CrO4溶液中滴加稀硫酸,溶液颜色变深 | |
| C. | 红棕色的NO2加压后颜色先变深后逐渐变浅 | |
| D. | 氯气中混有氯化氢,可通过饱和NaCl溶液除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Al(OH)3
Al(OH)3 AlO2-+H++H2O,加入NaOH溶液,H+被中和,浓度减低,Al(OH)3不断溶解.
AlO2-+H++H2O,加入NaOH溶液,H+被中和,浓度减低,Al(OH)3不断溶解.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 近年来江南地区多次发生断肠草被当作“金银花”误食而使人中毒致死的事件.断肠 草为中国古代九大毒药之一,据记载能“见血封喉”,现代查明它是葫蔓藤科植物葫蔓藤,其中的毒素很多,下列是分离出来的四种毒素的结构简式.下列有关说法正确的是( )
近年来江南地区多次发生断肠草被当作“金银花”误食而使人中毒致死的事件.断肠 草为中国古代九大毒药之一,据记载能“见血封喉”,现代查明它是葫蔓藤科植物葫蔓藤,其中的毒素很多,下列是分离出来的四种毒素的结构简式.下列有关说法正确的是( )| A. | ②中所含官能团种类比③中多 | |
| B. | ①、④互为同系物 | |
| C. | ①、②、③、④均由C、H、O三种元素组成 | |
| D. | 等物质的量的②、③分别在足量氧气中完全燃烧,前者消耗氧气比后者少 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
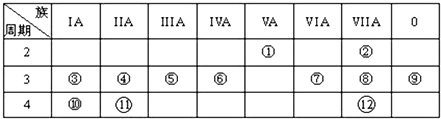
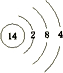 ,写出①的气态氢化物分子的电子式
,写出①的气态氢化物分子的电子式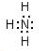 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中不可能含有共价键 | |
| B. | 非金属单质分子中一定存在共价键 | |
| C. | 离子化合物中不一定含有离子键 | |
| D. | 含有共价键的化合物不一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2与水的反应:3NO2+H2O═2NO3-+NO+2H+ | |
| B. | 氯气通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 向NH4HCO3溶液中加过量NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 向硅酸钠溶液中通入SO2:SiO32-+2H+═H2SiO3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com