
| A. | 将SO2气体通入NaClO溶液中:SO2+ClO-+H2O=SO32-+2HClO | |
| B. | 向FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| C. | 三氯化铝溶液与足量的氨水反应:Al3++4OH-=[Al(OH)4]- | |
| D. | 用三氯化铁溶液腐蚀铜印刷电路板:2Fe3++Cu=Cu2++2Fe2+ |
分析 A.发生氧化还原反应生成硫酸钠、盐酸;
B.亚铁离子、溴离子均全部被氧化;
C.反应生成氢氧化铝和氯化铵;
D.发生氧化还原反应生成氯化铜、氯化亚铁.
解答 解:A.将SO2气体通入NaClO溶液中的离子反应为SO2+ClO-+H2O=SO42-+2H++Cl-,故A错误;
B.向FeBr2溶液中通入过量Cl2的离子反应为2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,故B错误;
C.三氯化铝溶液与足量的氨水反应的离子反应为Al3++3NH3.H2O=Al(OH)3↓+3NH4+,故C错误;
D.用三氯化铁溶液腐蚀铜印刷电路板的离子反应为2Fe3++Cu=Cu2++2Fe2+,遵循电子、电荷守恒,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ①③④⑤ | C. | ①②③④⑥ | D. | ①③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠在空气中加热,生成淡黄色固体:2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2 | |
| B. | 向硫酸铝溶液中加入氨水制备氢氧化铝:Al3++3NH3•H2O═Al(OH)3 ↓+3NH4+ | |
| C. | 铁在潮湿的环境中生锈:3Fe+4H2O═Fe3O4+4H2↑ | |
| D. | 二氧化氮溶于水有硝酸生成:3NO2 +H2O═2HNO3+NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率主要取决于②的快慢 | B. | NOBr2是该反应的催化剂 | ||
| C. | 该反应的焓变等于akJ•mol-1 | D. | 反应速率:v(NO)=v(NOBr)=2v(Br2) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器编号 | 起始时各物质的物质的量/mol | 达平衡时能量的变化 | |||
| N2 | H2 | NH3 | Ar | ||
| ① | 1 | 3 | 0 | 0 | 放出热量Q1 |
| ② | 0.9 | 2.7 | 0.2 | 0 | 放出热量Q2 |
| ③ | 0.9 | 2.7 | 0.2 | 0.1 | 吸收热量Q3 |
| A. | 放出热量大小:Q1 >Q2 =Q3 | B. | 容器中的压强:③>①=2 | ||
| C. | N2的转化率:①<②<③ | D. | 平衡时NH3的体积分数:①=②<③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四种元素的原子半径:r(Z)>r(X)>r(Y)>r(W) | |
| B. | X、Y、Z、W形成的单质最多有6种 | |
| C. | 四种元素均可与氢元素形成18电子分子 | |
| D. | 四种元素中.Z的最高价氧化物对应水化物酸化最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲~辛等元素在周期表中的相对物质如下表,甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的~( )
甲~辛等元素在周期表中的相对物质如下表,甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的~( )| A. | 金属性,甲>乙>丁 | |
| B. | 原子半径,辛>戊>甲 | |
| C. | 形成的最简单氢化物的稳定性,己>戊 | |
| D. | 丙与庚的元素原子核外电子数相差13 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机化学中加氢和去氧都属于还原反应 | |
| B. | 裂化是化学变化,裂化产物是饱和烃 | |
| C. | “地沟油”的分子中含有不饱和键,加氢能改善其稳定性 | |
| D. | “地沟油”去氧时,氧主要以H2O和CO2等形式脱去 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
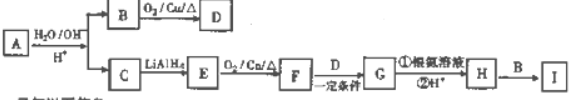
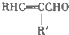 +H2O
+H2O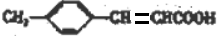 +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$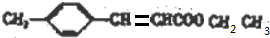 +H2O,反应类型为取代反应(酯化反应).
+H2O,反应类型为取代反应(酯化反应).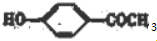 (写结构简式).
(写结构简式).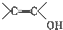 )结构.
)结构.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com