
【题目】一定温度下,在三个容积均为1.0L的恒容密闭容器中发生反应:CH3OH(g)+CO(g) ![]() CH3COOH(g)ΔH<0。下列说法正确的是
CH3COOH(g)ΔH<0。下列说法正确的是
容器编号 | 温度/K | 物质的起始浓度/mol/L | 物质的平衡浓度/mol/L | ||
c(CH3OH) | c(CO) | c(CH3COOH) | c(CH3COOH) | ||
I | 600 | 1.0 | 1.0 | 0 | 0.80 |
II | 600 | 0.40 | 0.40 | 0.80 | |
III | 575 | 0 | 0 | 1.0 | |
A. 达平衡时,容器II中![]() 比容器I中的大
比容器I中的大
B. 达平衡时,容器Ⅲ中的正反应速率比容器I中的大
C. 达平衡时,容器I与容器II中的总压强之比为5:6
D. 达平衡时,容器Ⅲ中c(CH3COOH)小于0.80mol/L
【答案】A
【解析】
A.容器I和II的温度相同,将II中起始物质按化学计量数转换成反应物,相当于起始加入1.2mol CH3OH和1.2molCO,相对于容器I,容器II相当于增大压强,平衡正向移动,![]() 增大,所以达平衡时,容器II中
增大,所以达平衡时,容器II中![]() 比容器I中的大,故A正确;
比容器I中的大,故A正确;
B. 将容器III中起始物质按化学计量数转换成反应物,相当于起始加入1.0mol CH3OH和1.0molCO,与容器I中起始加入物质相同,但容器I比容器III的温度高,温度越高,化学反应速率越大,则达平衡时,容器Ⅲ中的正反应速率比容器I中的小,故B错误;
C. 容器I和容器II的容积、温度均相同,则达平衡时,容器I与容器II中的总压强之比等于气体总物质的量之比,容器I中平衡时c(CH3OH)=(1.0-0.80)mol/L=0.20mol/L、c(CO)=(1.0-0.80)mol/L=0.20mol/L、c(CH3COOH)= 0.80mol/L,平衡常数K=![]() =20,气体总物质的量为(0.20+0.20+0.80)mol/L×1L=1.20mol,设容器II中达到平衡时c(CH3OH)=a mol/L,则c(CO)=a mol/L、c(CH3COOH)= (0.40-a+0.80)mol/L=(1.20-a)mol/L,容器I和容器II的温度相同,则K=
=20,气体总物质的量为(0.20+0.20+0.80)mol/L×1L=1.20mol,设容器II中达到平衡时c(CH3OH)=a mol/L,则c(CO)=a mol/L、c(CH3COOH)= (0.40-a+0.80)mol/L=(1.20-a)mol/L,容器I和容器II的温度相同,则K=![]() =20,解得a≈0.22mol/L,所以平衡时容器II中气体总物质的量为(0.22+0.22+0.98)mol/L×1.0L=1.42mol,达平衡时,容器I与容器II中的总压强之比为
=20,解得a≈0.22mol/L,所以平衡时容器II中气体总物质的量为(0.22+0.22+0.98)mol/L×1.0L=1.42mol,达平衡时,容器I与容器II中的总压强之比为![]() >
>![]() ,故C错误;
,故C错误;
D. 若容器III和容器I的温度相同,则二者为等效平衡,容器III达到平衡时c(CH3COOH)等于0.80mol/L,但容器III的温度低于容器I,降低温度平衡正向移动,c(CH3COOH)增大,所以达平衡时,容器Ⅲ中c(CH3COOH)大于0.80mol/L,故D错误,答案选A。


科目:高中化学 来源: 题型:
【题目】可逆反应:L(s)+aG(g)![]() bR(g) ΔH达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.下列判断正确的是
bR(g) ΔH达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.下列判断正确的是

A. ΔH<0
B. 增加L的物质的量,可提高G的转化率
C. 升高温度,G的转化率减小
D. a<b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是三种有机物的结构简式,下列说法正确的是( )
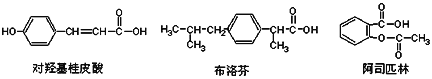
A. 三种有机物都能发生水解反应
B. 三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种
C. 三种物质中,其中有两种互为同分异构体
D. 三种物质在一定条件下,均可以被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、 向KI和硫酸混合溶液中加入过氧化氢溶液,迅速反应放出大量气泡,溶液呈棕色。
查阅资料知,反应过程如下:
①H2O2+2KI+H2SO4=I2+K2SO4+2H2O;
②H2O2+I2=2HIO;
③H2O2+2HIO=I2+O2↑+2H2O
(1)用双线桥法表示过程①电子转移情况:H2O2+2KI+H2SO4=I2+K2SO4+2H2O_____________。
(2)只比较上述反应②与③,则判断I2起到了___________的作用。
(3)试判断,酸性条件下HIO、H2O2、O2三种物质氧化性的强弱:___________(填化学式)。
II、一定条件下,向含硝酸的废水中加入CH3OH(碳元素为-2价),将HNO3还原成N2。若参加反应的还原剂和氧化剂的物质的量之比是5∶6,则该反应中被氧化的元素的化合价为_____;每转移3 mol电子,反应消耗_____g CH3OH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜、磷及其化合物是非常重要的物质。
(1)Cu+的电子排布式____;
(2)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-。[Cu(CN)4]2-的配体为____,[Cu(CN)4]2-中C的杂化方式为____,则1个[Cu(CN)4]2-中含有的σ键的数目为____个;
(3)锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,不溶于水,可通过Na3PO4、CuSO4和NH3·H2O反应制取。制取Cu4O(PO4)2的化学方程式为____;
(4)PCl5中P-Cl键长有198pm和206pm两种。PCl5是非极性分子,可作为导电熔体,其原理为PCl5电离为一个阴离子和一个阳离子,其中阴离子为正八面体,阳离子为正四面体,写出一种阳离子的等电子体的化学式____,PCl5的立体构型为____;
(5)金属铜属于面心立方晶体,铜的密度为ag·cm3,NA表示阿伏伽德罗常数,则铜的配位数____,铜的金属半径为___pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示)。下列说法错误的是
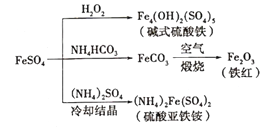
A. 碱式硫酸铁水解能产生Fe(OH)3胶体,可用做净水剂
B. 该温度下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
C. 可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D. 为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车的启动电源常用铅蓄电池,电池反应如下: PbO2 + Pb + 2H2SO4 ![]() 2PbSO4+ 2H2O,根据此反应判断下列叙述中正确的是( )
2PbSO4+ 2H2O,根据此反应判断下列叙述中正确的是( )
A. PbO2放电时是电池的负极,充电时是电池的阳极
B. 负极的电极反应式为:Pb + SO42—– 2e–=PbSO4
C. 放电时,PbO2得电子,被氧化
D. 电池放电时,溶液酸性增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com