
【题目】(1)已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l) △H1
2 H2(g)+ O2(g)= 2H2O(g) △H2
C(s)+ O2(g)=CO2(g) △H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为__________
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH
①取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的ΔH_______0(填“>”、“<”或“=”,下同)

②在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线I、Ⅱ对应的平衡常数关系为KⅠ_____________KⅡ。
【答案】12△H3+5△H2-2△H1 < >
【解析】
(1)本题考查热化学反应方程式的计算,6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)①,2H2(g)+ O2(g)= 2H2O(g)②,C(s)+ O2(g)=CO2(g) ③,根据目标反应方程式,③×12-①×2+②×5,得出△H=12△H3-2△H1+5△H2;(2)本题考查勒夏特列原理和平衡常数,①线的最高点说明反应达到平衡,最高点右侧,温度升高CH3OH的体积分数降低,说明升高温度,平衡向逆反应方向进行,正反应为放热反应,即正反应△H<0;②II比I先达到平衡,II的温度比I高,该反应正反应方向是放热反应,化学平衡常数只受温度的影响,即KI>KII。


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
【题目】2002年诺贝尔化学奖获得者的贡献之一是发明了对有机分子的结构进行分析的质谱法。其方法是让极少量(10-9g左右)的化合物通过质谱仪的离子化室使样品分子大量离子化,少量分子碎裂成更小的离子。如C2H6离子化后可得到C2H6+、C2H5+、C2H4+、……然后测定其质荷比β。设H+的质荷比为1,某有机物样品的质荷比如下图(假设离子均带一个单位正电荷,信号强度与该离子多少有关),则该有机物可能
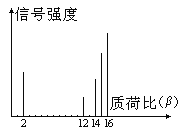
A. CH3OH B. C3H8 C. C2H4 D. CH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,AgX(X=CI、Br)的溶度积与c(Ag+)和c(X-)的相互关系如图所示,其中A线表示AgCl,B线表示AgBr,已知p(Ag+)=-lgc(Ag+),p(X-)=-lgc(X-)。下列说法正确的是
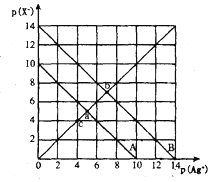
A. c点可表示AgCl的不饱和溶液
B. b点的AgCl溶液加入AgNO3晶体可以变成a点
C. AgCl(s)+Br-(aq) →AgBr(s)+CI(aq)平衡常数K=10-4
D. a点AgCl溶液和b点AgBr溶液等体积混合,会析出AgBr沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是( )
A. SO3+ H2O= H2SO4 B. NH4Cl ![]() NH3
NH3![]() +HCl
+HCl![]()
C. Fe+CuSO4= FeSO4+Cu D. NaOH+HNO3=NaNO3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取O2和Cl2的化学反应方程式分别为①2KClO3 ![]() 2KCl+3O2↑;②MnO2+4HCl(浓)
2KCl+3O2↑;②MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,则下列说法正确的是( )
MnCl2+Cl2↑+2H2O,则下列说法正确的是( )
A. 均为氧化还原反应
B. ②中MnO2为还原剂
C. ①中反应前后MnO2质量不发生变化
D. ①中反应前后MnO2化学性质改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以“物质的量”为中心的计算是化学计算的基础,下列与“物质的量”相关的计算正确的是
A. 有CO、CO2、O3三种气体,它们各含有1 mol O,则三种气体物质的量之比为3:2:1
B. n g Cl2中有m个Cl原子,则阿伏加德罗常数NA的数值可表示为35.5m/n
C. 常温下,a L氧气和氮气的混合物含有的分子数就是(a/22.4)×6.02×1023个
D. 28 g CO和22.4 L CO2中含有的碳原子数一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验(苯,一种不溶于水,密度比水小的液体):
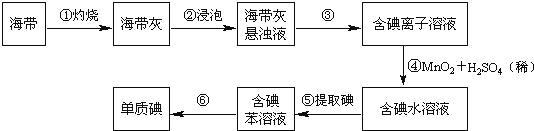
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是_______(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是_______;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是_______。
(3)步骤⑤是萃取、分液,某学生选择用苯来提取碘的理由是_______。在分液操作中,应充分振荡,然后静置,待分层后______(填标号),以下略。
A.直接将含碘苯溶液从分液漏斗上口倒出
B.直接将含碘苯溶液从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将含碘苯溶液从下口放出
D.先将水层从分液漏斗的下口放出,再将含碘苯溶液从上口倒出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用过量锌粒与稀硫酸反应制取氢气,欲加快化学反应速率而不改变产生氢气的量,下列措施不可行的是( )
A. 升高温度B. 加入少量CuSO4固体C. 滴加少量浓硝酸溶液D. 改用等质量的锌粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空题。
(1)47.5g某二价金属的氯化物中含有1molCl-,则该金属氯化物的摩尔质量为_______ ;该金属的相对原子质量为_______ 。
(2)标准状况下,3.4g NH3 的体积为_______ ;它与标准状况下_______ L H2S含有相同数目的氢原子。
(3)已知CO、CO2混合气体的质量共10.0g,在标准状况下的体积为6.72L,则混合气体中CO的质量为_______ ;CO2在相同状况下的体积为_______ 。
(4)将4g NaOH 溶解在10mL水中,再稀释成1L,从中取出10mL,这10mL溶液的物质 的量浓度为_______。
(5)已知ag氢气中含有b个氢原子,则阿伏加德罗常数的值可表示为 _______ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com