
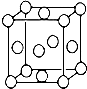
 某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1. 其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)dn+6nsl,回答下列问题.
某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1. 其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)dn+6nsl,回答下列问题. ,E为铜元素,是29号元素,所以原子的核外有 29种不同运动状态的电子,C为氧元素,由于氮元素最外层电子是半满状态,是一种稳定状态,所以氮元素的第一电离能大于氧元素,故答案为:第三周期ⅥA族;
,E为铜元素,是29号元素,所以原子的核外有 29种不同运动状态的电子,C为氧元素,由于氮元素最外层电子是半满状态,是一种稳定状态,所以氮元素的第一电离能大于氧元素,故答案为:第三周期ⅥA族; ;29;N>O;
;29;N>O; ,由于H2O与H2O2之间形成氢键,两种化合物可任意比互溶,
,由于H2O与H2O2之间形成氢键,两种化合物可任意比互溶, ;H2O和H2O2之间形成氢键;
;H2O和H2O2之间形成氢键;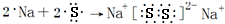 ,
,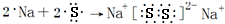 ;
;| 1 |
| 8 |
| 1 |
| 2 |
| ||
| a3 |
| 256 |
| ρ?a3 |
| 6+2 |
| 2 |
| ||
| 256 |
| ρ?a3 |
| ||


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
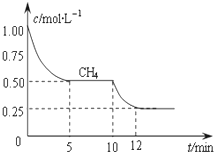 合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生的反应有:
合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生的反应有:| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、△H3=△H1+2△H2 |
| B、△H3=△H1+△H2 |
| C、△H3=△H1-2△H2 |
| D、△H3=△H1-△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com