
| A. | SO2可大量用于漂白食品 | B. | 干冰、AgI均可用于人工降雨 | ||
| C. | 四氧化三铁常用作红色油漆和涂料 | D. | 小苏打的主要成份是Na2CO3 |
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:实验题
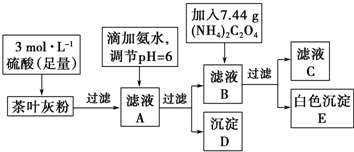
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | X、W的最外层电子数均为6 | B. | 最高价氧化物的水化物的碱性:Y>Z | ||
| C. | 简单气态氢化物的稳定性:W>X | D. | Y的单质在X的单质中燃烧生成Y2X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O | |
| B. | CH3CH2OH+HBr$\stackrel{△}{→}$C2H5Br+H2O | |
| C. | 2CH3CH2OH$→_{140℃}^{浓硫酸}$C2H5OC2H5+H2O | |
| D. | CH3Cl+Cl2$\stackrel{光照}{→}$CH2Cl2+HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com