
【题目】 A、B、C、D、M均为中学化学常见物质,它们的转化关系如下图所示(部分生成物和反应条件略去)。A与水的反应在常温下进行。下列推断不正确的是( )
A. 若A为淡黄色固体,则D可能为CO
B. 若M为可溶性铝盐,则D可能为白色沉淀,且M(D)=M(A)
C. 若D为小苏打,C转化为D的反应是CO2+H2O+CO32-=2HCO3-,则A可能为氯气
D. 若C为CO2,则A一定为化合物
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】研究发现某些金属离子如 Fe3+、Cu2+等对H2O2的分解也具有催化作用,为了比较 MnO2与 Fe3+和Cu2+的催化效果,某同学设计了如图甲、乙所示的实验。
请回答相关问题:
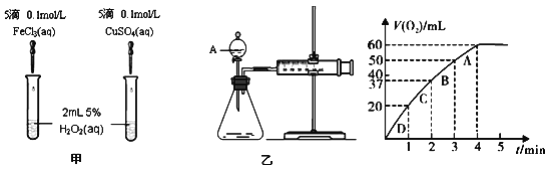
(1)定性分析:图甲可通过观察__________(填写相关实验现象), 定性比较得出结论。有同学提出将FeCl3 改为 Fe2(SO4)3 或者将 CuSO4 改为 CuCl2 更为合理,其理由是______________。
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。检查乙装置气密性的方法是_____________,实验中需要测量的数据是___________。
(3)加入0.10mol MnO2 粉末于50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示.
①实验时放出气体的总体积是_______mL, 反应放出气体所需时间约为_________min。
②A、B、C、D各点反应速率快慢的顺序为 D>C>B>A.解释反应速率变化的原因:______________。
③计算 H2O2 的初始物质的量浓度为__________mol/L。(保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁中常见的反应为:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) △H
2Fe(s)+3CO2(g) △H
(1)某实验小组在实验室模拟上述反应。一定温度下,在2L盛有Fe2O3粉末的恒容密闭容器中通入0.1molCO,5min时生成2.24gFe。5min内有CO表示的平均反应速率是______________mol·L-1min-1;5min时CO2的体积分数为___________;若将此时反应体系中的混合气体通入100mL0.9mol/L的NaOH溶液中,充分反应后所得溶液中离子浓度由大到小的顺序是__________________ 。
(2)上述反应的平衡常数表达式为:K=_______________;下列能说明该反应已经达到平衡状态的是_____________(填序号)。
a.容器内固体质量保持不变
b.容器中气体压强保持不变
c.c(CO)=c(CO2)
d.v正(CO)=v逆(CO2)
(3)已知上述反应的平衡常数K与温度T(单位:K)之间的关系如图所示,其中直线的斜率为-![]() (气体常数R=8.3×10-3kJ·mol-1·K-1)。
(气体常数R=8.3×10-3kJ·mol-1·K-1)。
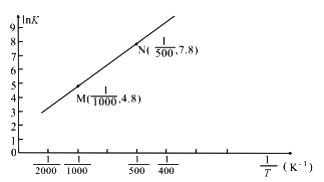
①根据图像可知,该反应的平衡常数随温度升高而____________(填“增大”、“减小”或“不变”)
②该反应的△H=_______________kJ·mol-1。
(4)结合上述有关信息,写出两条提高CO转化率的措施_____________、_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法没有体现“结构决定性质”的事实是
A. 丙烷的沸点比甲烷高
B. 金刚石比石墨更硬
C. 乙烯可以使溴水褪色,而乙烷不能
D. 金属钠比镁更活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)![]() C(s)+xD(g);△H>0,容器中A、B、D的物质的量浓度随时间的变化如图所示。下列说法不正确的是
C(s)+xD(g);△H>0,容器中A、B、D的物质的量浓度随时间的变化如图所示。下列说法不正确的是
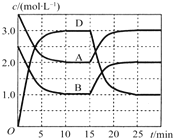
A.反应在前10min的平均反应速率v(B)=0.15mol/( L ·min)
B.该反应的平衡常数表达式K=![]()
C.若平衡时保持温度不变,压缩容器体积平衡向逆反应方向移动
D.反应至15min时,改变的条件是降低温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向硫酸铜水溶液中逐滴加入氨水,先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,再向溶液中加入乙醇有深蓝色晶体(化学式为[Cu(NH3)4]SO4·H2O)析出。
(1)写出上述实验前两步反应的离子方程式__________,____________。
(2)铜元素基态原子的电子排布式为_________________,铜单质晶体中的原则堆积模型属于_________堆积(填堆积模型名称)。
(3)在上述深蓝色晶体所含的非金属元素中,电负性最大的是_________(填元素符号),第一电离能最大的是_________(填元素符号)。该晶体中的阴离子的立体构型是_________,阴离子的中心原子的杂化方式为_________。
(4)氨的沸点_________(填“高于”或“低于”)膦(PH2),原因是_____________。
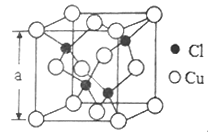
(5)Cu的一种氯化物晶胞结构如图所示,该氯化物的化学式是______________。若该晶体的密度为pg·cm-3,以NA表示阿伏伽德罗常数,则该晶胞的边长为a=_____________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 焰色反应是化学变化
B. 电子从基态跃迁到激发态放出能量,产生发射光谱
C. 在一定条件下,碳原子的电子排布式可能是1s22s12p3
D. 自然界的原子都是基态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017届浙江省名校协作体高三下学期】
恒温恒容装置中发生如下反应:A(g)+2B(g)![]() 2C(g) ΔH = -a kJ·mol-1(a>0),开始时充入一定量的A和B,B的反应速率随时间变化如下图所示。下列说法正确是
2C(g) ΔH = -a kJ·mol-1(a>0),开始时充入一定量的A和B,B的反应速率随时间变化如下图所示。下列说法正确是
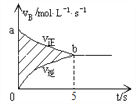
A. 反应放出的热量一定小于a kJ
B. 5s后,反应停止,各物质浓度保持不变
C. 5s末,ν(A)︰ν(B)=1︰2
D. 阴影部分面积可以表示A的物质的量浓度减少量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0 g,若上述气体为NO和NO2的混合物,且体积比为1﹕1,则V可能为( )
A.9.0L B.13.5L C.15.7L D.16.8L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com