
乙酸是醋的主要成分,而醋几乎贯穿了整个人类文明史,其中有文献记载的酿醋历史至少也在三千年以上。
(1)写出乙酸在水溶液中的电离方程式_____________
(2)25℃下,CH3COOH在水中电离的ΔH为+8.8kJ/mol,电离常数Ka为2×10-5,又知HCl(aq)与NaOH(aq)反应的ΔH为-57.3kJ/mol,则CH3COONa水解时的ΔH为_____,水解平衡常数为Kh为_______。
近年来,研究者利用乙酸开发出新工艺合成乙酸乙酯,使产品成本明显降低,其主要反应为:
CH2=CH2(g)+CH3COOH(l)  CH3COOC2H5(l)
CH3COOC2H5(l)
(3)该反应属于有机反应类型中的_____________。
(4)下列描述能说明乙烯与乙酸合成乙酸乙酯的反应已达化学平衡的是____________。
A.乙烯、乙酸、乙酸乙酯的浓度相同
B.酯化合成反应的速率与酯分解反应的速率相等
C.乙烯断开1mol碳碳双键的同时乙酸恰好消耗1mol
D.体系中乙烯的百分含量一定
下图为n(乙烯)与n(乙酸)物料比为1时,在不同压强下进行了在相同时间点乙酸乙酯的产率随温度的变化的测定实验,实验结果如图所示。回答下列问题:
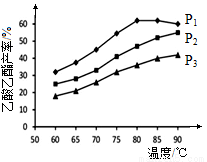
(5)温度在60~80℃范围内,乙烯与乙酸酯化合成反应速率由大到小的顺序是________[用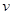 (P1)、
(P1)、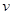 (P2)、
(P2)、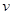 (P3)分别表示不同压强下的反应速率],分析其原因为____________。
(P3)分别表示不同压强下的反应速率],分析其原因为____________。
(6)压强为P1MPa、温度60℃时,若乙酸乙酯的产率为30℅,则此时乙烯的转化率为_______。
(7)压强为P1MPa、温度超过80℃时,乙酸乙酯产率下降的原因可能是_________。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2017届福建省厦门市高三下学期第一次质量检测理综化学试卷(解析版) 题型:选择题
X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如右图所示。下列说法错误是
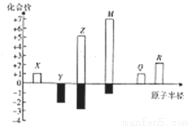
A. Q位于第三周期IA族
B. X、Y、Z三种元素组成的化合物可能是盐或碱
C. 简单离子半径:M->Q+>R2+
D. Z与M的最高价氧化物对应水化物均为强酸
查看答案和解析>>
科目:高中化学 来源:山东省2016-2017学年高一3月月考化学试卷 题型:选择题
下列有关能量的说法不正确的是( )
A. 化石能源物质内部贮存着大量的能量
B. 植物的光合作用使太阳能转化为化学能
C. 由石墨制金刚石是吸热反应,故石墨能量比金刚石能量低
D. 燃料燃烧时只是将化学能转化为热能
查看答案和解析>>
科目:高中化学 来源:2017届陕西省咸阳市高三二模理综化学试卷(解析版) 题型:填空题
1.
纳米级Cu2O由于具有优良的催化性能而备受关注,下表为制取纳米级Cu2O的三种方法:
窗体顶端
方法Ⅰ | 用炭粉在高温条件下还原CuO |
方法Ⅱ | 电解法,反应为2Cu+H2O |
方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是反应条件不易控制,若控温不当易生成________而使Cu2O产率降低。
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H =-akJ·mol-1
C(s)+1/2O2(g)=CO(g) △H =-bkJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H =-ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H =_____。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,电解装置如下图所示。
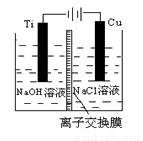
①阴极上的产物是________ 。
②阳极生成Cu2O,其电极反应式为_________。
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该反应的化学方程式为____________。
(5)肼又称联氨,易溶于水,是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因______。
(6)向1L恒容密闭容器中充入0.1molN2H4,在30℃、Ni-Pt催化剂作用下发生反应N2H4(g) N2(g)+2H2(g),测得混合物体系中,
N2(g)+2H2(g),测得混合物体系中,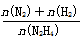 (用y表示)与时间的关系如图所示。0-4min时间内H2的平均生成速率v(H2)=____mol/(L·min);该温度下,反应的平衡常数=_______。
(用y表示)与时间的关系如图所示。0-4min时间内H2的平均生成速率v(H2)=____mol/(L·min);该温度下,反应的平衡常数=_______。
(7)肼-空气清洁燃料电池是一种碱性燃料电池,电解质溶液时20%-30%的KOH溶液。肼-空气燃料电池放电时,负极的电极反应式是_________。电池工作一点时间后,电解质溶液的pH将_______(填“增大”、“减小”、“不变”)。
查看答案和解析>>
科目:高中化学 来源:2017届陕西省咸阳市高三二模理综化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A. 分子式为C5H12O的有机物,分子中含有2个甲基的同分异构体有4种
B. 乙烷、苯、氯乙烯等三种有机化合物分子内所有原子均在同一平面上
C. 由乙酸和乙醇制乙酸乙酯的反应及油脂的水解反应均属于取代反应
D. 乙烯和苯都能使溴水褪色,且褪色的原理相同
查看答案和解析>>
科目:高中化学 来源:2017届四川省南充市高三第二次高考适应性考试理综化学试卷(解析版) 题型:选择题
利用下图装置可以进行实验并能达到实验目的的是
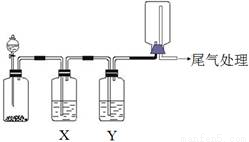
选项 | 实验目的 | X中试剂 | Y中试剂 |
A | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
B | 用Cu与稀硝酸制取并收集纯净干燥的NO | 水 | 浓硫酸 |
C | 用CaO于浓氨水制取并收集纯净干燥的NH3 | NaOH溶液 | 碱石灰 |
D | CaCO3和稀盐酸制取并收集纯净干燥的CO2 | 饱和NaHCO3溶液 | 浓硫酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南京市、盐城市高三第二次模拟考试化学试卷(解析版) 题型:实验题
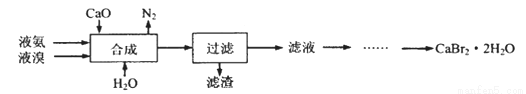
溴化钙晶体(CaBr2·2H2O)为白色固体,易溶于水,可用于制造灭火剂、制冷剂等。一种制备溴化钙晶体的工艺流程如下:
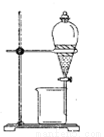
(1)实验室模拟海水提溴的过程中,用苯萃取溶液中的溴,分离溴的苯溶液与水层的操作是(装置如下图):使玻璃塞上的凹槽对准漏斗上的小孔,将活塞拧开,使下面的水层慢慢流下,待有机层和水层界面与活塞上口相切即关闭活塞,______________。
(2)“合成”的化学方程式为___________________。 “合成”温度控制在70℃以下,其原因是__________。投料时控制n(Br2):n(NH3)= 1:0.8,其目的是__________________。
(3)“滤渣”的主要成分为_________________(填化学式)。
(4)“滤液”呈强碱性,其中含有少量BrO-、BrO3-,请补充从“滤液”中提取CaBr2·2H2O的实验操作:加热驱除多余的氨,______________。[实验中须使用的试剂有:氢溴酸、活性炭、乙醇;除常用仪器外须使用的仪器有:砂芯漏斗,真空干燥箱]
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南京市、盐城市高三第二次模拟考试化学试卷(解析版) 题型:选择题
下列化学用语表示正确的是
A. 中子数为16的硫原子: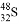 B. Cl-的结构示意图:
B. Cl-的结构示意图: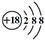
C. 甲酸甲酯的结构简式:HCOOCH3 D. 氢氧化钠的电子式: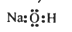
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省西安市高二下学期第一次教学检测化学试卷(解析版) 题型:选择题
已知C﹣C单键可以绕键轴旋转,某烃结构简式可表示为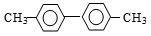 ,下列说法中正确的是
,下列说法中正确的是
A. 分子中至少有9个碳原子处于同一平面上
B. 该烃的一氯代物只有一种
C. 分子中至少有10个碳原子处于同一平面上
D. 该烃是苯的同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com