
【题目】下图是实验室制取二氧化硫并验证二氧化硫的某些性质的装置,试回答:
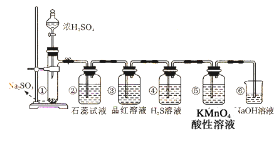
(1)在①中发生反应的化学方程式为_____________。
(2)②中的实验现象为紫色石蕊试液_________,此实验证明二氧化硫是_____气体。
(3)③中的品红溶液_________,证明二氧化硫有________性。
(4)④中的实验现象是______________,证明二氧化硫有__________性。
(5)⑤中的实验现象是________________,证明二氧化硫有____________性。
(6)⑥的作用是________,反应的化学方程式为________。
【答案】Na2SO3+H2SO4(浓) =Na2SO4+H2O+SO2↑ 变红 酸性 褪色 漂白 有淡黄色沉淀生成 氧化 高锰酸钾溶液褪色 还原 吸收二氧化硫,防止二氧化硫污染环境 SO2+2NaOH=Na2SO3+H2O
【解析】
由实验装置图可知,装置①中亚硫酸钠和浓硫酸反应制备二氧化硫气体,二氧化硫是酸性氧化物,与水反应生成亚硫酸,使②中紫色石蕊试液变红,二氧化硫具有漂白性,能使③中的品红溶液褪色,SO2具有氧化性,能与④中具有还原性的氢硫酸反应生成S沉淀,SO2具有还原性,能与⑤中酸性高锰酸钾溶液反应,使酸性高锰酸钾溶液褪色;二氧化硫有毒,不能直接排放到空气中,用⑥中氢氧化钠溶液吸收二氧化硫,防止二氧化硫污染环境。
(1)①中亚硫酸钠和浓硫酸反应生成硫酸钠、二氧化硫气体和水,反应的化学方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(2)②中为紫色石蕊试液,二氧化硫溶于水和水反应生成中强酸亚硫酸,亚硫酸可以使紫色石蕊试液变红,故答案为:紫色石蕊溶液变红; 酸性;
(3)③中为品红溶液,二氧化硫具有漂白性,与品红化合生成无色物质,使品红溶液褪色,故答案为:褪色;漂白;
(4)SO2中+4价S具有氧化性,硫化氢中-2价S具有还原性,二氧化硫能把硫化氢氧化成单质硫,本身被还原成单质硫,反应方程式为SO2+2H2S=3S↓+2H2O,③中的现象是有淡黄色沉淀生成,故答案为:有淡黄色沉淀生成;氧化;
(5)二氧化硫具有还原性,能够使高锰酸钾溶液褪色,故答案为:高锰酸钾溶液褪色;还原;
(6)二氧化硫有毒,不能直接排放到空气中,酸性氧化物二氧化硫能够与氢氧化钠反应生成亚硫酸钠和水,⑥中氢氧化钠溶液的作用是吸收二氧化硫,防止污染空气,反应的化学方程式为:2NaOH+SO2=Na2SO3+H2O,故答案为:吸收二氧化硫,防止二氧化硫污染环境;2NaOH+SO2=Na2SO3+H2O。


科目:高中化学 来源: 题型:
【题目】《本草纲目》中记载,小米“健脾、和胃、安眠”,这主要是某种氨基酸的作用。下列有机物水解能生成氨基酸的是( )
A.蔗糖B.蛋白质C.油脂D.纤维素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物质的溶液 ①CH3COOH ②HCl ③H2SO4 ④NaHSO4
(1)若四种溶液的物质的量浓度相同,其c(H+)最大的是________(用序号表示,下同)。
(2)若四种溶液的c(H+)相同,其物质的量浓度最大的是________。
(3)将pH相同的上述四种溶液与Zn反应生成等量氢气,所需时间最短的是_________。
(4)将6 g CH3COOH溶于水制成1 L溶液,此溶液的物质的量浓度为________,经测定溶液中c(CH3COO-)为1.4×10-3 mol·L-1,此温度下醋酸的电离常数Ka=________,(写出计算式,不必计算最终结果)。温度升高,Ka将______(填“变大”、“不变”或“变小”)。
(5)在常温下将pH=11的NaOH溶液a L与pH=2的H2SO4溶液b L混合,若混合后溶液呈中性,则a:b=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在外界提供相同电量的条件,Cu2+或Ag+分别按Cu2++2e→Cu或Ag++e-→Ag在电极上放电,若析出铜的质量为1.92g,则析出银的质量为
A.1.62gB.6.48gC.3.24gD.12.96g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为分析某盐的成分, 做了如下实验:
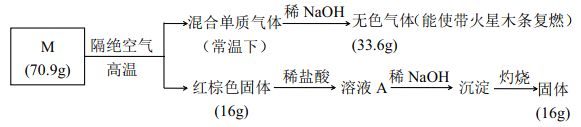
请回答:
(1)盐 M 的化学式是_________;
(2)被 NaOH 吸收的气体的电子式____________;
(3)向溶液 A 中通入H2S 气体, 有淡黄色沉淀产生, 写出反应的离子方程式________ (不考虑空气的影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列中心原子的杂化轨道类型和分子几何构型不正确的是
A. PCl3中P原子sp3杂化,为三角锥形
B. BCl3中B原子sp2杂化,为平面三角形
C. H2S分子中,S为sp杂化,为直线形
D. CS2中C原子sp杂化,为直线形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种装饰品的主要成分,是地壳中含量最高的两种元素形成的化合物。根据下图转化关系,回答下列问题。

(1)A的用途:________(任写一种),B是________,D是________。
(2)写出下列反应的化学方程式:①______________。
(3)写出下列反应的离子方程式:②____________,③_______,⑤____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KIO3可采用电解法制备,装置如图所示。下列叙述正确的是

A. 通电后阴极的电极反应式2H2O+2e-=2OH-+H2↑
B. 电解过程中通过阳离子交换膜的离子主要为K+,其迁移方向是从右到左
C. 电解过程中阳极附近pH增大
D. 当电路中通过1mol电子的电量时,会有0.5mol的KIO3生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠与水反应时产生的各种现象如下:①钠浮在水面上;②钠沉在水底;③钠熔化成小球;④小球迅速游动,逐渐减小,最后消失;⑤发出嘶嘶的声音;⑥滴入酚酞后溶液显红色。其中正确的一组是
A. ①③④⑤⑥ B. ①②③④⑤ C. ①②③⑥ D. 全部
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com