
【题目】已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下:
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(1)被氧化的元素是________,被还原的元素是______。
(2)发生氧化反应的物质是__________,发生还原反应的物质是__________。
(3)用双线桥法表示反应电子得失的方向和数目__________________________
【答案】Cu N Cu HNO3 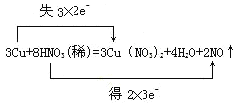
【解析】
(1)所含元素化合价降低的物质为氧化剂,所含元素化合价升高的物质为还原剂,还原剂对应的产物为氧化产物;
(2)还原剂失电子,化合价升高,发生氧化反应;氧化剂得电子,化合价降低,发生还原反应;
(3)根据Cu元素的化合价变化、N元素的化合价变化来分析,化合价升高的元素原子失去电子,化合价降低的元素的原子得到电子,化合价升高值=化合价降低值=转移电子数。
(1)N元素的化合价降低,被还原;Cu元素的化合价升高,被氧化;则被氧化的元素是Cu,被还原的元素是N;
(2)在反应3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O中,Cu元素的化合价由0升高到+2价,N元素的化合价由+5降低为+2价,则发生氧化反应的物质是Cu,发生还原反应的物质是HNO3;
(3)在反应3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O中,Cu元素的化合价由0升高到+2价,N元素的化合价由+5降低为+2价,转移的电子为6e-,则双线桥法标出电子得失的方向和数目为 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知:①Fe+H2SO4(稀)=FeSO4+H2↑
②Cu+2H2SO4(浓) ![]() CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
③KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
请回答下列问题:
(1)当反应①转移3摩尔电子时,消耗H2SO4的质量是______g,产生氢气的体积(标准状况)_________L。
(2)反应②中_________作氧化剂,___________是氧化产物。
(3)当反应②中生成11.2LSO2气体(标准状况下)时,被还原的H2SO4的物质的量是____________。
(4)用单线桥法表示反应③电子转移的方向和数目。KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
______________
(5)反应③中盐酸表现_________________性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g) △H=-53.7kJ/mol;向2L 恒容恒温密闭容器中充入1mol CO2和2.8molH2反应,图中过程I、Ⅱ是在两种不同催化剂作用下建立平衡的过程中CO2的转化率[α(CO2)]随时间(t)的变化曲线。下列说法不正确的是
H2O(g)+CH3OH(g) △H=-53.7kJ/mol;向2L 恒容恒温密闭容器中充入1mol CO2和2.8molH2反应,图中过程I、Ⅱ是在两种不同催化剂作用下建立平衡的过程中CO2的转化率[α(CO2)]随时间(t)的变化曲线。下列说法不正确的是

A. m点:v(正)>v(逆)
B. 活化能:过程Ⅱ>过程I
C. n点时该反应的平衡常数K=50
D. 过程I,t2时刻改变的反应条件可能是升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。下列关于滤液中的离子浓度关系不正确的是
A. ![]() <1.0×10-7mol/L
<1.0×10-7mol/L
B. c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2CO3)
C. c(H+)+c(NH4+)= c(OH-)+ c(HCO3-)+2 c(CO32-)
D. c(Cl-)> c(NH4+)> c(HCO3-)> c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有效去除大气中的H2S、SO2以及废水中的硫化物是环境保护的重要课题。
(1)去除废气中H2S的相关热化学方程式如下:
2H2S(g)+3O2(g)=2H2O(l)+2SO2(g);ΔH=akJ·mol-1
2H2S(g)+SO2(g)=2H2O(l)+3S(s);ΔH=bkJ·mol-1
反应2H2S(g)+O2(g)=2H2O(l)+2S(s)的ΔH=__kJ·mol-1。
为了有效去除废气中的H2S,在燃烧炉中通入的H2S和空气(O2的体积分数约为20%)体积比一般控制在0.4,理由是__。
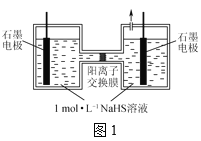
(2)电化学氧化法是一种高效去除废水中硫化物的方法,电解NaHS溶液脱硫的原理如图1所示。碱性条件下,HS-首先被氧化生成中间产物Sn2-,S n2-容易被继续氧化而生成硫单质。
①阳极HS-氧化为S n2-的电极反应式为___。
②电解一段时间后,阳极的石墨电极会出现电极钝化,导致电极反应不能够持续有效进行,其原因是___。
(3)用CO(NH2)2(N为-3价)水溶液吸收SO2,吸收过程中生成(NH4)2SO4和CO2。该反应中的氧化剂是__。
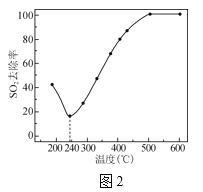
(4)在一定条件下,CO可以去除烟气中的SO2,其反应原理为2CO+SO2=2CO2+S。其他条件相同、以比表面积大的γ—Al2O3作为催化剂,研究表明,γ—Al2O3在240℃以上发挥催化作用。反应相同的时间,SO2的去除率随反应温度的变化如图2所示。240℃以前,随着温度的升高,SO2去除率降低的原因是__。240℃以后,随着温度的升高,SO2去除率迅速增大的主要原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.1 mol O2中含有1.204×1024个氧原子,在标准状况下占有体积22.4L
B.同温、同压下,相同体积的气体都含有相同数目的分子
C.同温、同压下,相同质量的气体都占有相同的体积
D.由0.2gH2和8.8gCO2、5.6gCO组成混合气体,其密度是相同状况下O2密度的0.913倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量在计算中有广泛的应用,请完成下列各小题:
(1)9gH2O与__________gH3PO4所含分子数相等。
(2)固体X在一定条件下加热分解,其方程式为2X![]() Y↑+2Z↑+2W↑,测得生成的混合气体的密度是相同状况下H2的a倍,则X的相对分子质量为__________。
Y↑+2Z↑+2W↑,测得生成的混合气体的密度是相同状况下H2的a倍,则X的相对分子质量为__________。
(3)在同温同压下,6.5g某气体A的分子数与7gC2H4的分子数相等,则气体A在标准状况下的密度为__________gL-1(结果保留三位有效数字)。
(4) b%的硫酸溶液与4b%的硫酸溶液等质量混合后,所得溶液中溶质的质量分数__________(填“>”、“<”或“=”,下同)2.5b%;如果等体积混合,所得溶液中溶质的质量分数__________2.5b%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青金石是碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氧、氧等元素,曾用来制作颜料。
(1)在周期表中,与Si的化学性质最相似的邻族元素是_________。
(2) Na+和 Ne互为等电子体,电离能 I2(Na)_________I1(Ne)填"〉”或“<")。
(3)已知氯、硫有多种含氧酸,HClO4中共价键类型有_____,硫酸的结构式为_____。
(4)氢卤酸(HX)的电离过程如图。△H1和△H2的递变规律:HF > HCl> HBr >HI,其中△H1(HF)特别大的原因为________,影响△H2递变的因素为________。
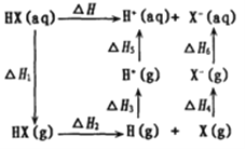
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com