
| A. | 950 mL 111.2 g | B. | 500 mL 117.0 g | ||
| C. | 1000 mL 117.0 g | D. | 1000 mL 111.2 g |
科目:高中化学 来源: 题型:解答题
 置换反应的通式可表示为如图所示:请回答下列问题:
置换反应的通式可表示为如图所示:请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.请认真观察如图,然后回答问题.
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.请认真观察如图,然后回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | △H<0 | B. | △H>0 | C. | △H=0 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素A、B组成的化合物常温下不一定呈气态 | |
| B. | 元素C、D的最高价氧化物对应的水化物之间不能发生反应 | |
| C. | 化合物AE与CE含有相同类型的化学键 | |
| D. | 工业上常用电解法电解熔融的DE3制备元素D的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的$\frac{1}{4}$
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的$\frac{1}{4}$查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 58.5 g的氯化钠固体中含有NA个氯化钠分子 | |
| B. | 0.1 L 3 mo1•L-1的NH4NO3溶液中含有的NH4+数目为0.3×6.02×1023 | |
| C. | 5.6 g铁粉与硝酸反应失去的电子数一定为0.3×6.02×1023 | |
| D. | 4.5 g SiO2晶体中含有的硅氧键数目为0.3×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①、③是置换反应,②是化合反应 | |
| B. | 高温下,焦炭与氢气的还原性均弱于硅 | |
| C. | 任一反应中,每消耗或生成28 g硅,均转移4 mol电子 | |
| D. | 在第三个反应中,SiCl4作氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
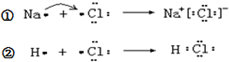 下列说法不正确的是( )
下列说法不正确的是( )| A. | ①和②变化过程中都会放出热量 | |
| B. | 氯原子吸引电子的能力强于钠原子和氢原子 | |
| C. | NaCl中含有离子键,HCl中含有极性共价键 | |
| D. | ①和②中的氯原子均得到1个电子达到8电子稳定结构 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com