
分析 (1)FeCl3与铁反应可生成FeCl2;
(2)可用碳酸氢钠溶液除杂;
(3)可通入氯气除杂.
解答 解:(1)FeCl3与铁反应可生成FeCl2,反应的离子方程式为2Fe3++Fe═3Fe2+,故答案为:2Fe3++Fe═3Fe2+;
(2)可用碳酸氢钠溶液除杂,反应的离子方程式为H++HCO3-═H2O+CO2↑,故答案为:H++HCO3-═H2O+CO2↑;
(3)可通入氯气除杂,反应的离子方程式为Cl2+2Br-═2Cl-+Br2,故答案为:Cl2+2Br-═2Cl-+Br2.
点评 本题考查除杂及离子反应方程式的书写,为高考常见题型,注意除杂的原则及物质的性质即可解答,侧重氧化还原反应的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | FeO放入稀HCl中 | |
| B. | CuCl2的混合溶液中加入过量的铁粉 | |
| C. | Fe在氯气中燃烧后的产物 | |
| D. | 过量Fe粉放入FeCl3溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
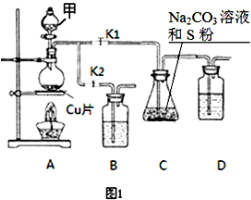 硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图1.
硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图1.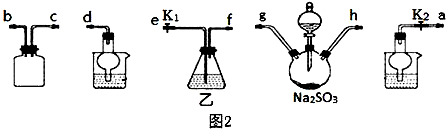
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 一定存在SO42-、CO32-、NH4+,可能存在K+、Cl-、Na+ | |
| B. | 一定存在SO42-、CO32-、NH4+、Na+、Cl-,一定不存在K+、Na+ | |
| C. | c(CO32-)=0.01 mol•L-1,c(NH4+)>c(SO42-) | |
| D. | 如果上述6种离子都存在,则c(Cl-)>c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 有机物 属于芳香烃,含有两种官能团 属于芳香烃,含有两种官能团 | |
| B. | 按系统命名法,化合物 的名称为2,3,6三甲基5乙基庚烷 的名称为2,3,6三甲基5乙基庚烷 | |
| C. |  既属于醇类又属于羧酸 既属于醇类又属于羧酸 | |
| D. | 2甲基3丁烯的命名错误原因是选错了主链 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
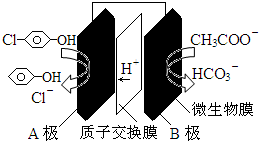
| A. | A极电极反应式为: +2e-+H+═ +2e-+H+═ +Cl- +Cl- | |
| B. | B极电极反应式为:CH3COO--8e-+4H2O═2HCO3-+9H+ | |
| C. | 溶液中的阴离子由A极向B极移动 | |
| D. | 该微生物电池在高温条件下无法正常工作 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 LH2O含有NA个水分子 | |
| B. | 标准状况下,22.L空气含有NA个单质分子 | |
| C. | 常温常压下,11.2 L氯气所含的原子数目为NA | |
| D. | 标准状况下,1.12 L O2 和1.12 L CO2均含有0.1NA氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
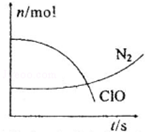
| A. | 还原剂是含CN-的物质,氧化产物不只有N2 | |
| B. | 氧化剂是ClO-,还原产物是HCO3- | |
| C. | 参与反应的氧化剂与还原剂的物质的量之比为5:2 | |
| D. | 标准状况下若生成2.24LN2则转移电子1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2CO3和NaHCO3形成的混合溶液中:2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)] | |
| B. | 0.1mol•L-1NaHSO3溶液中通入NH3至溶液pH=7:c(Na+)>c(NH4+)>c(SO32-) | |
| C. | 物质的量浓度相等的:①(NH4)2SO4溶液、②NH4HCO3溶液、③NH4Cl溶液、④(NH4)2Fe(SO4)2溶液中c(NH4+)的大小关系:④>①>②>③ | |
| D. | 0.1mol•L-1CH3COONa溶液中通入HCl至溶液pH=7:c(Na+)>c(CH3COOH)=c(Cl-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com