
【题目】工业上硝酸的制备和自然界中硝酸的生成既有相同的地方,又有区别。下图路线中的①-③、Ⅰ-Ⅲ分别是工业生产硝酸和雷电高能固氮过程中硝酸的生成途径。回答下列问题: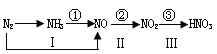
(1)雷电高能固氮生产硝酸的三个反应中,是否均为氧化还原反应?_______。
(2)图中途径I、①和②对应的三个反应中,常温下就能进行的是途径________。
(3)途径③对应的反应为NO2+H2O—HNO3+NO(未配平),该反应过程中氧化产物和还原产物的物质的量之比为__________________。
(4)硝酸必须保存于棕色瓶里并置于阴凉处的原因是____________________;可用铝质或铁质容器盛放冷的浓硝酸的原因是_____________________。
(5)硝酸的用途之一是与氨气反应制硝酸铵,其化学方程式为_____________。
【答案】 是 ② 2:1 硝酸光照、受热易分解 浓硝酸使铁、铝钝化 HNO3+NH3=NH4NO3
【解析】(1)在反应过程中有元素化合价变化的化学反应叫做氧化还原反应;在氧化还原反应中,所含元素的化合价降低的反应物,叫做氧化剂;所含元素的化合价升高的反应叫做还原剂。所以雷电高能固氮生产硝酸的三个反应中,均为氧化还原反应。
(2)一氧化氮常温下与氧气反应生成二氧化氮。
(3)3NO2+H2O=2HNO3+NO反应中,硝酸为氧化产物,一氧化氮为还原产物。
(4)硝酸具有不稳定性,见光受热易分解;常温下,铁铝遇浓硝酸发生钝化。
(5)硝酸与氨气反生成硝酸铵。
(1)在反应过程中有元素化合价变化的化学反应叫做氧化还原反应;在氧化还原反应中,所含元素的化合价降低的反应物,叫做氧化剂;所含元素的化合价升高的反应叫做还原剂。所以雷电高能固氮生产硝酸的三个反应中,①I![]() (氧化剂:
(氧化剂:![]() ,还原剂:
,还原剂:![]() ),②II.
),②II.![]() (氧化剂:
(氧化剂:![]() ,还原剂:
,还原剂:![]() ),③III.
),③III.![]() (氧化剂:
(氧化剂:![]() ,还原剂:
,还原剂:![]() ),通过以上分析可知,均为氧化还原反应;正确答案:是。
),通过以上分析可知,均为氧化还原反应;正确答案:是。
(2)氮气和氧气放电反应,氨气和氧气加热条件下发生催化氧化,一氧化氮常温下与氧气反应,因此常温下就能进行的是途径②;正确答案:②。
(3)根据电子守恒和质量守恒,配平该反应:3NO2+H2O=2HNO3+NO,NO2中+4价氮元素升高到HNO3中+5价氮元素,发生氧化反应,氧化产物有2mol,NO2中+4价氮元素降低到NO中+2价氮元素,发生还原反应,还原产物有1 mol,因此该反应过程中氧化产物和还原产物的物质的量之比为2:1 ;正确答案:2:1。
4)硝酸具有不稳定性,见光受热易分解,因此硝酸必须保存于棕色瓶里并置于阴凉处;常温下,浓硝酸能够使铁或铝发生钝化,因此可用铝质或铁质容器盛放冷的浓硝酸;正确答案:硝酸光照、受热易分解;浓硝酸使铁、铝钝化。
(5)硝酸与氨气反生成硝酸铵,化学方程式为:HNO3+NH3=NH4NO3;正确答案:HNO3+NH3=NH4NO3。


科目:高中化学 来源: 题型:
【题目】铁铝榴石颜色深红,是宝石界中最常见的石榴子石,其化学成分为Fe2Al2( SiO4)3O铁铝榴石中所含元系不属于短周期元素的是
A.AlB.FeC.SiD.O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 3.8 g H37Cl和3H35Cl组成混合气体中含中子数为2NA
B. 22.4 L(标准状况)二溴乙烷中含有C-Br 键数为2NA
C. lmol Na 在0.5 molO2中燃烧至充分,转移电子数为2NA
D. 1L2 mol·L-l 氨水中加盐酸至中性时,生成NH4+数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用固体NaOH配制一定物质的量浓度的NaOH溶液,下列操作正确的是
A.称量时,将固体NaOH直接放在天平左盘上
B.将称量好的固体NaOH放入容量瓶中,加蒸馏水溶解
C.定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分
D.将烧杯中溶解固体NaOH所得溶液,冷却到室温后转移至容量瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关仪器的使用方法或实验操作正确的是( )
A. 用容量瓶配制溶液时,若加水超过刻度线,立即用滴定管吸出多余液体
B. 酸式滴定管装标准液前,必须先用该溶液润洗
C. 酸碱中和滴定实验中,用待测溶液润洗锥形瓶以减小实验误差
D. 洗净的锥形瓶和容量瓶可以放进烘箱中烘干
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、O、Si、S、Fe是重要的化学元素,在中学化学中对它们的单质和化合物的研究颇多。
(1)C、O、Si三种元素第一电离能由大到小的顺序是_______________________。
(2)CS2是重要的溶剂,CS2中C原子的杂化方式为_____________,其空间构型为_______________。
(3)基态Fe原子中,核外电子占据最高能层的符号是________,占据该能层电子的电子云轮廓图形状为_______________。
(4)晶胞推导有助于我们理解晶体结构。
①将NaC1晶胞(如右图)中的所有C1-去掉,并将Na+全部换成Si原子,再在间隔的“小立方体”中心处各放置一个Si原子便构成了晶体Si的一个晶胞,若再在每两个距离最近的Si原子中心连线的中点处增添一个O原子,便构成了SiO2晶胞。由此可推算SiO2晶胞中有______个Si原子,______个O原子。
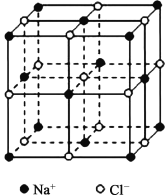
②简述利用NaC1晶胞推导出CsC1晶胞的方法:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断错误的是( )
xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断错误的是( )
A. x=1
B. B的转化率为40%
C. 2 min内A的平均反应速率为0.3 mol·(L·min)-1
D. 若混合气体的密度不变则表明该反应达到平衡状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com