
| A. | 0.5molH2所占的体积约为11.2L | |
| B. | 标准状况下,6.02×1023个分子所占的体积约是22.4L | |
| C. | H2的摩尔质量为2g•mo l-1 | |
| D. | 阿伏伽德罗常数就是6.02×1023,没有单位 |
分析 A、氢气所处的状态不一定是标准化状况,气体摩尔体积不一定是22.4L/mol;
B、气体分子是22.4L,固体和液体体积远小于22.4L;
C、摩尔质量以g/mol为单位,数值上等于其相对分子质量;
D、阿伏伽德罗常数单位为mol-1.
解答 解:A、氢气所处的状态不一定是标准化状况,气体摩尔体积不一定是22.4L/mol,0.5mol H2所占体积不一定为11.2L,故A错误;
B、气体分子是22.4L,固体和液体体积远小于22.4L,所以标准状况下,6.02×1023个气体分子所占的体积约是22.4L,故B错误;
C、摩尔质量的单位是g•mo l-1,所以H2的摩尔质量为2g•mo l-1,故C正确;
D、阿伏伽德罗常数单位为mol-1,故D错误;
故选C.
点评 本题考查气体摩尔体积、阿伏伽德罗常数、摩尔质量等,侧重对基础知识的考查,注意气体摩尔体积的使用条件与对象.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与等物质的量稀硫酸混合:Ba2++2OH-+2H++SO42-═BaSO4↓+2 H2O | |
| B. | 少量CO2通入澄清石灰水中:Ca(OH)2+CO2═CaCO3↓+H2O | |
| C. | 铜片插入硝酸银溶液中:Cu+2Ag+═Cu2++2Ag | |
| D. | 碳酸钡溶于稀盐酸中:BaCO3+2H+═Ba2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;写成B与足量NaHCO3溶液完全反应的化学方程式:
;写成B与足量NaHCO3溶液完全反应的化学方程式: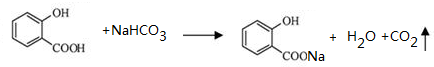 .
. .
. )是一种重要的有机合成中间体.根据图中提示的信息,试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).
)是一种重要的有机合成中间体.根据图中提示的信息,试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在氧气中燃烧,1 mol O2作氧化剂时得到的电子数为4NA | |
| B. | 常温常压下,22.4L氦气含有NA个氦原子 | |
| C. | 标准状况下,22.4LCCl4所含有的原子数目为5NA | |
| D. | 1mol Na2O2与足量H2O反应,转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图1用于放出碘的四氯化碳溶液 | |
| B. | 图2用于实验室收集SO2 | |
| C. | 图3用于实验室制备Fe(OH)2 | |
| D. | 图4用于比较NaHCO3和Na2CO3热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 题述反应条件下还原性:CO>Pd | |
| B. | 题述反应中PdCl2被氧化 | |
| C. | 生成22.4 L CO2时,转移的电子为2 mo1 | |
| D. | CO气体只有在高温下才能表现还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在容积为10L的容器中,850℃和t1℃(高于850℃)时分别发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),△H<0
在容积为10L的容器中,850℃和t1℃(高于850℃)时分别发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),△H<0| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com