
| A. | 由水电离产生的c(H+)=10-12 mol•L一1的溶液中:K+、Na+、Fe2+、NO3- | |
| B. | 常温下,pH=7的溶液中:Al3+、Cl-、HCO3-、SO42- | |
| C. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、Cu2+、S2-、Cl- | |
| D. | pH=1的溶液中:Fe3+、NO3-、SO42-、Na+ |
分析 A.由水电离产生的c(H+)=10-12 mol•L一1的溶液,为酸或碱溶液;
B.离子之间相互促进水解;
C.常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液,显酸性;
D.pH=1的溶液,显酸性.
解答 解:A.由水电离产生的c(H+)=10-12 mol•L一1的溶液,为酸或碱溶液,酸溶液中Fe2+、NO3-发生氧化还原反应,碱溶液中不能大量存在Fe2+,故A不选;
B.Al3+、HCO3-相互促进水解,不能共存,故B不选;
C.常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液,显酸性,不能大量存在S2-,且S2-、Cu2+结合生成沉淀不能共存,故C不选;
D.pH=1的溶液,显酸性,该组离子之间不反应,可大量共存,故D选;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源:2016-2017学年河北省高一上10月月考化学试卷(解析版) 题型:填空题
(1)已知16克A和20克B恰好完全反应生成0.05mol C和30克D,则C的摩尔质量为_________(2)0.3mol氨气和0.4mol二氧化碳的质量___________(填“相等”或“不相等”,下 同),
同),
所含原子数____________。
(3)4 g H2与22.4 L(标准状况)CO2相比,所含分子数目较多的是____________。
(4)3.01×1023个CO2分子中含 mol氧原子,在标准状况下其体积为 L,它与 g H2O含有相同的氧原子数。
(5)写出下列物质的电离方程式:硫酸铵__________ ____;氢氧化钡_______ ___。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上第一次学段考试化学卷(解析版) 题型:选择题
“绿色化学”的主要内容之一是从技术、经济上设计可行的化学反应,使原子充分利用,不产生污染物.下列化学反应不符合“绿色化学”理念的是( )
A.制氯乙烷:CH2=CH2+HCl CH3CH2Cl
CH3CH2Cl
B.制甲基丙烯酸甲酯:CH3C≡CH+CO+CH3OH  CH2=C(CH3)COOCH3
CH2=C(CH3)COOCH3
C.制CuSO4:2Cu+O2 = 2CuO,CuO+H2SO4(稀)═CuSO4+H2O
D.制Cu(NO3)2:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
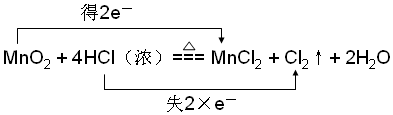 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
有一支50mL酸式滴定管其中盛有溶液,液面恰好在10mL刻度处,现把管内溶液全部流下排出,用量筒承接,该溶液的体积应为
A.10mL B.40mL C.大于40mL D.小于40mL
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1s22s22p63s23p63d104s1 | B. | 1s22s22p63s23p63d64s2 | ||
| C. | 1s22s22p63s23p63d34s2 | D. | 1s22s22p63s23p63d44s2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂,可加快反应速率,目的是提高生产效率 | |
| B. | 使用冰箱保存食物,是利用了化学反应速率理论 | |
| C. | 化学反应速率理论是研究怎样提高原料转化率 | |
| D. | 化学平衡理论是研究怎样使用有限原料多出产品 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com