
【题目】某化学科研小组在其他条件不变时,改变某一条件对反应[可用aA(g)+bB(g)![]() cC(g)表示的化学平衡的影响,得到如下图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率)。根据图象,下列判断正确的是( )
cC(g)表示的化学平衡的影响,得到如下图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率)。根据图象,下列判断正确的是( )




A.反应I:若p1>p2,则此反应只能在高温下自发进行
B. 反应Ⅱ:此反应的ΔH<0,且T1<T2
C.反应Ⅲ:表示t1时刻一定是使用催化剂对反应速率的影响
D.反应Ⅳ:表示t1时刻增大B的浓度对反应速率的影响
 英才计划期末调研系列答案
英才计划期末调研系列答案 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述错误的是 ( )
A. 含16g氧原子的二氧化碳分子中含有的δ键数目为2NA
B. 3.9 g Na2O2晶体中含有0.15NA个离子
C. 常温常压下,5gD2O含有的质子数、电子数、中子数均为2.5NA
D. 2molSO2和1molO2在一定条件下反应所得混合气体分子数小于2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )
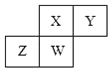
A. 原子半径:Z>W>X>Y
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. ZY2晶体熔化、液态Y3气化均需克服分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体的最外电子层结构,则下列有关说法不正确的是( )
A.1 mol NH5中含有5 NA个N﹣H键(NA表示阿伏加德罗常数)
B.NH5中既有共价键又有离子键
C.NH5的电子式为![]()
D.它与水反应的离子方程式为NH4++H﹣+H2O=NH3H2O+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时在10 mL 0.1mol·L—1Na2CO3溶液中逐滴加入0.1 mol·L—1HCl溶液20 mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示。下列说法不正确的是

A.HCl溶液滴加一半时,溶液pH>7
B.当溶液的pH=8时,溶液中NaHCO3的物质的量浓度为0.1mol·L—1
C.0.1 mol·L—1Na2CO3溶液中c(Na+)+c(H+)=c(OH—)+2c(CO32—)+c(HCO3—)
D.在M点:c(Na+)>c(CO32—)=c(HCO3—)>c(OH—)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液中能大量共存的一组离子是( )
A.Na+、Ca2+、Cl﹣、SO42﹣
B.Fe2+、H+、SO32﹣、ClO﹣
C.Mg2+、NH4+、Cl﹣、SO42﹣
D.K+、Fe3+、NO3﹣、SCN﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下:Ksp(AgCl)=1.6×10-10,下列叙述正确的是 ( )
A.AgCl在饱和NaCl溶液中的Ksp比在纯水中的小
B.AgCl的悬浊液中c(Cl-)=4×10-5.5mol/L
C.将0.001 mol·L-1AgNO3溶液滴入0.001 mol·L-1的KCl,无沉淀析出
D.向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl)<Ksp(AgBr)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据物质的溶解性“相似相溶”的一般规律,说明溴、碘单质在四氯化碳中比在水中溶解度大,下列说明中正确的是()
A. 溴、碘单质和四氯化碳中都含有卤素
B. 溴、碘是单质,四氯化碳是化合物
C. Br2、I2是非极性分子,CCl4也是非极性分子,而水是极性分子
D. 以上说法都不对
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com