
| A. | 称量12.5g固体NaOH时,将砝码放在左盘上,NaOH放在右盘上 | |
| B. | 选用的容量瓶中有少量蒸馏水 | |
| C. | 定容时俯视刻度线 | |
| D. | 定容摇匀后,液面下降,又加水至刻度线 |
分析 根据实验操作对c=$\frac{n}{V}$=$\frac{\frac{m}{M}}{V}$的影响进行判断,判断是否对配制溶液的浓度有影响.
解答 解:A.称量时药品和砝码位置颠倒,导致称量的溶质质量减小,配制的溶液中溶质的物质的量减小,浓度偏低,故A正确;
B.容量瓶洗净后未烘干,定容时还需要加入蒸馏水,所以不影响配制结果,故B错误;
C.定容时俯视刻度线,导致配制的溶液体积偏低,浓度偏高,故C错误;
D.定容摇匀后发现液体体积低于刻度线,再补加少量蒸馏水至刻度线,会导致溶液的体积偏大,配制溶液的浓度偏小,故D正确;
故答案为:AD.
点评 本题考查了一定物质的量浓度溶液的配制,难度不大,会根据C=$\frac{n}{V}$判断配制溶液浓度的误差.


科目:高中化学 来源: 题型:解答题
 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
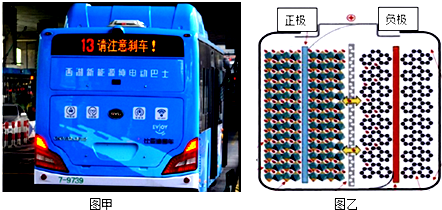
| A. | 充电时阳极反应可表示为LiFePO4-xe-=Li1-xFePO4+xLi+ | |
| B. | 充电时阴极反应可表示为xLi++xe-+6C=LixC6 | |
| C. | 放电时负极反应可表示为LixC6-xe-=xLi++6C | |
| D. | 放电时Li+从左向右通过离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| CH3COOH | H2CO3 | H2S | H3PO4 |
| 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molC60F60分子中非极性共价键数目为60NA | |
| B. | 2.1gDTO分子中所含中子数为NA | |
| C. | 4.6gN2O4和NO2混合物中含的电子数为2.3NA | |
| D. | aml1mol/L的H2B溶液中,测得溶液中无H2B分子,则溶液中阴离子数为aNA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
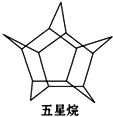 化学家合成了一种新物质-五星烷,它的分子立体结构如图所示:
化学家合成了一种新物质-五星烷,它的分子立体结构如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com