


科目:高中化学 来源: 题型:

| 实验步骤 | 实验操作 | 实验现象 |
| Ⅰ | 将反应后得到黑色粉末X(假定为均匀的),取出少量放入另一试管中,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
| Ⅱ | 向实验Ⅰ中得到的溶液滴加几滴KSCN溶液,振荡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| n(CH3)OH |
| n(CO) |
| 3 |
| 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有大量HCO3-的澄清透明溶液中:K+、C6H5O-、Cl-、Na+ |
| B、能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、Fe2+ |
| C、常温下水电离出的c(H+)?c(OH-)=10-20的溶液中:Na+、ClO-、S2-、NH4+ |
| D、pH=7的溶液:Fe3+、Mg2+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L乙醇中含有的碳原子数目为2NA |
| B、1mol CnH2n含有的共同电子对数为(3n+1)NA |
| C、1mol CO2与1mol Na2O2完全反应时,转移的电子数目为NA |
| D、1mol/L的FeCl3溶液中,所含Fe3+的数目小于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向亚硫酸氨铵溶液中加入足量的氢氧化钠溶液:NH4++OH-=NH3?H2O |
| B、钠投入冷水中:Na+2H2O=Na++2OH-+H2↑ |
| C、向氯化铝溶液中加入过量氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ |
| D、铜丝插入稀硝酸中:Cu+NO-3+4H+=Cu2++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
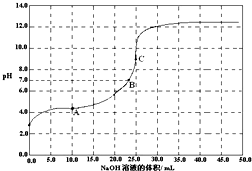 常温时,用0.1000mol/L NaOH 滴定 25.00mL 0.1000mol/L某一元酸HX,滴定过程中pH 变化曲线如图所示.下列说法正确的是( )
常温时,用0.1000mol/L NaOH 滴定 25.00mL 0.1000mol/L某一元酸HX,滴定过程中pH 变化曲线如图所示.下列说法正确的是( )| A、滴定前,酸中c(H+) 等于碱中c(OH-) |
| B、在A点,c(Na+)>c(X-)>c(HX)>c(H+)>c(OH-) |
| C、在B点,两者恰好完全反应 |
| D、在C点,c(X-)+c(HX)=0.05 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 化学反应 | 离子方程式 | 评价 | |||||||||||||||
| A | 碳酸钙与醋酸反应 | C
|
错误,碳酸钙是弱电解质,不应写成离子形式 | |||||||||||||||
| B | 向碳酸钠溶液中滴加过量的盐酸 | C
|
正确 | |||||||||||||||
| C | 向澄清石灰水中滴加少量KHC
|
HC
|
错误,不满足Ca(OH)2的配比 | |||||||||||||||
| D | 硫酸氢钠溶液与足量氢氧化钡溶液混合 | 2H++S
|
正确 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com