


 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:
| A、地沟油的主要成分是高级脂肪酸甘油酷,可用于制肥皂和加工食用油 |
| B、棉、麻、丝、毛及合成纤维完全燃烧都只生成C02和H20,对环境不会有影响 |
| C、BaSO4在医学上用作钡餐,Ba2+对人体无毒 |
| D、“落汤螃蟹着红袍”肯定发生了化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成.
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成.
| ||
| 冰晶石 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210.01 | -252.77 | -77.74 |
| 沸点(℃) | -195.79 | -259.23 | -33.42 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| N2 |
| △ |
| H2O |
| H2O |
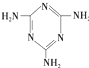 (三聚氰胺)
(三聚氰胺) ),三聚氰酸分子中N原子采取
),三聚氰酸分子中N原子采取 是电石的晶胞示意图,则一个晶胞中含有
是电石的晶胞示意图,则一个晶胞中含有查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10mL水 |
| B、10mL 0.1mol/LCaCl2溶液 |
| C、20mL 0.1mol/LNaHSO4 |
| D、40mL 0.1mol/LNa2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、锌为负极,锌发生还原反应Zn-2e-=Zn2+ |
| B、电流方向经外电路由锌到铜 |
| C、工作时SO42-离子向正极移动 |
| D、外电路电子流入的一极为正极,电子流出的一极为负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH3 O2 |
| B、H2O O2 |
| C、CO2 O2 |
| D、O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com