
| A. | HF、H2O、CH4、SiH4热稳定性由弱到强 | |
| B. | 微粒按半径从大到小顺序:K>Cl>K+ | |
| C. | C、N、O、F元素的最高正价由低到高 | |
| D. | 相同温度时物质的量浓度相等的NaCl、MgCl2、AlCl3三种溶液的pH值由小到大 |
分析 A.非金属性越强,简单氢化物的稳定性越强;
B.电子层越多,粒子半径越大,电子层相同时,核电荷数越大离子半径越小;
C.F元素为非金属性最强的元素,不存在正化合价;
D.氯化钠为中性,氯化镁和氯化铝溶液呈酸性.
解答 解:A.非金属性F>O>C>Si,则简单氢化物HF、H2O、CH4、SiH4的稳定性逐渐减弱,故A错误;
B.K+含有2个电子层,其离子半径最小;K、Cl都含有3个电子层,原子序数K<Cl,则原子半径K>Cl,则微粒按半径从大到小顺序:K>Cl>K+,故B正确;
C.C、N、O元素的最高正价由低到高,而F没有最高正化合价,故C错误;
D.相同温度时物质的量浓度相等的NaCl、MgCl2、AlCl3三种溶液,NaCl溶液呈中性,MgCl2、AlCl3呈酸性,氢氧化铝的碱性较弱,则氯化铝溶液的酸性较强,其溶液的pH最小,所以pH值由大到小的顺序为:NaCl、MgCl2、AlCl3,故D错误;
故选B.
点评 本题考查原子结构与元素周期律的应用,题目难度不大,明确元素周期律的内容即可解答,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 X、Y、Z、W、U五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57.Y原子的L层p轨道中有2个电子,Z的原子核外有三个未成对电子,W与Y原子的价电子数相同,U原子的K层电子数与最外层电子数比为2:1,其d轨道处于全充满状态.
X、Y、Z、W、U五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57.Y原子的L层p轨道中有2个电子,Z的原子核外有三个未成对电子,W与Y原子的价电子数相同,U原子的K层电子数与最外层电子数比为2:1,其d轨道处于全充满状态.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为53、中子数为78的碘原子:${\;}_{53}^{131}$ I | |
| B. | N2的电子式: | |
| C. | S2-的结构示意图: | |
| D. | 甲烷分子的比例模型是  |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 酚;
酚;  芳香烃;
芳香烃; 酯;
酯;  烯烃.
烯烃.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
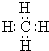 ,AxByCz的分子式AlC3H9.
,AxByCz的分子式AlC3H9.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| B | 向某溶液中滴加NaOH溶液,产生白色沉淀 | 该溶液中一定含有Al3+ |
| C | 向某溶液中加人NaOH浓溶液,加热,产生的气体能使湿润的 红色石蕊试纸变蓝 | 该溶液中一定含有NH4+ |
| D | 向某紫红色溶液中加人过量Na2SO3溶液,溶液紫红色褪去 | 该溶液中一定含有MnO4- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com