
| A. | 鱼、肉、虾等食品用福尔马林防腐保鲜 | |
| B. | 国际奥委会禁止使用的兴奋剂--麻黄碱 | |
| C. | 向伤口处涂一定浓度的双氧水溶液可以杀菌消毒 | |
| D. | 误食铜、汞、铜等重金属,立即喝牛奶或鸡蛋清解毒 |
分析 A.HCHO有毒,能使蛋白质发生变性;
B.麻黄碱为拟肾上腺素药,能兴奋交感神经,药效持久,口服有效.它能松弛支气管平滑肌、收缩血管,有显著的中枢兴奋作用,麻黄碱是国际奥委会严格禁止的兴奋剂;
C.双氧水有强氧化性;
D.重金属盐可以使蛋白质发生变性.
解答 解:A.HCHO有毒,不能用于鱼、肉、虾等食品保鲜,可用于生物标本的防腐,故A错误;
B.麻黄碱为拟肾上腺素药,能兴奋交感神经,是国际奥委会严格禁止的兴奋剂,故B正确;
C.双氧水有强氧化性,能杀菌消毒,则向伤口处涂一定浓度的双氧水溶液可以杀菌消毒,故C正确;
D.重金属盐可以是蛋白质变性,所以误食后会中毒,服用大量的蛋清和牛奶后,可以和重金属反应,变为不被吸收的物质,减弱对肠胃的影响,故D正确;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的性质、用途等为解答的关键,侧重分析与应用能力的考查,注意化学与生活的联系,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | CH3COOH+CH3CH2OH $?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| B. | 2CH3CH2OH+O2 $→_{△}^{催化剂}$2CH3CHO+2H2O | |
| C. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl | |
| D. | 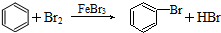 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
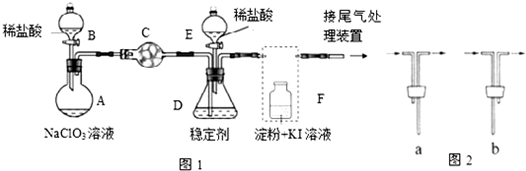
 氨氧化法是工业生产中制取硝酸的主要途径,某同学用该原理在实验室探究硝酸的制备和性质,设计了如图所示的装置.
氨氧化法是工业生产中制取硝酸的主要途径,某同学用该原理在实验室探究硝酸的制备和性质,设计了如图所示的装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
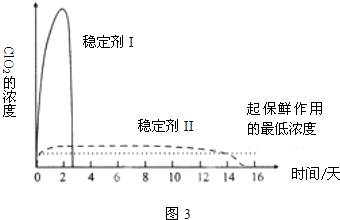
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
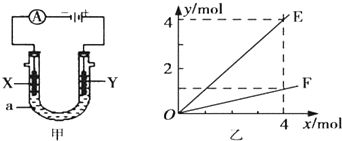
| A. | 若此装置用于电解精炼铜,则X为纯铜、Y为粗铜,电解的溶液a可以是硫酸铜或氯化铜溶液 | |
| B. | 按图甲装置用惰性电极电解AgNO3溶液,若图乙横坐标x表示流入电极的电子的物质的量,则E可表示反应生成硝酸的物质的量,F表示电解生成气体的物质的量 | |
| C. | 按图甲装置用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,加入0.5 mol的碳酸铜刚好恢复到通电前的浓度,则电解过程中转移的电子为2.0 mol | |
| D. | 若X、Y为铂电极,a溶液为500 mL KCl和KNO3的混合液,经过一段时间后,两极均得到标准状况下11.2 L气体,则原混合液中KCl的物质的量浓度至少为2.0 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | 只有①②③④ | C. | 只有①②③ | D. | 只有①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
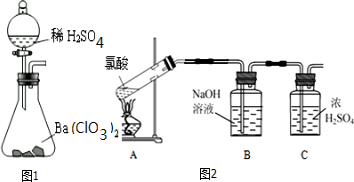
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若X和Y处于同一周期,则X的原子半径肯定小于Y的原子半径 | |
| B. | 若X和Y处于同一周期,且M属于共价化合物,则分子中原子个数比可能为1:2 | |
| C. | 若最外层电子数X>Y>2,则X的非金属性一定比Y的非金属性强 | |
| D. | 若M属于离子化合物,则该化合物中只存在离子键,且每个原子均达到8电子稳定结构 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com