
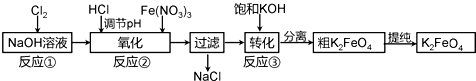
分析 由流程可知,反应①为氯气与氢氧化钠反应生成氯化钠、次氯酸钠与水,调节pH,发生3NaClO+2Fe(NO3)3+10NaOH═2Na2FeO4↓+3NaCl+6NaNO3+5H2O,过滤出NaCl,反应③发生Na2FeO4+2KOH═K2FeO4+2NaOH,该转化是在某低温下进行的,说明此温度下K2FeO4的溶解度小于Na2FeO4,过滤分离得到K2FeO4,以此解答(1)、(2);
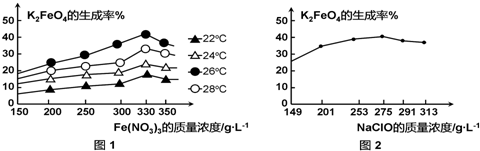
(3)①由图1可知,Fe(NO3)3浓度一定,温度在26℃时,K2FeO4的生成率最高.Fe(NO3)3浓度在375g/L时,K2FeO4的生成率最高,由图2可知,NaClO在255g/L时,K2FeO4的生成率最高,据此计算Fe(NO3)3与NaClO两种溶液最佳质量浓度之比.
②由信息可知,碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,根据元素守恒还应生成H2O,反应中FeO42-→FeO43-,铁元素化合价由+6价降低为+5价,总共降低1价,Fe3+→FeO43-,铁元素化合价由+3价升高为+5价,总共升高2价,化合价升降最小公倍数为2,所以FeO42-系数为2,Fe3+系数为1,根据铁元素守恒确定FeO43-系数,根据电荷守恒确定OH-系数,根据氢元素守恒确定H2O系数,检查氧元素守恒.
(4)K2FeO4 在水溶液中易水解呈碱性,应选择碱性非水溶液抑制K2FeO4水解,进行洗涤.
解答 解:(1)反应①为氯气与氢氧化钠反应生成氯化钠、次氯酸钠与水,反应离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(2)由流程图可知,“转化”(反应③)是Na2FeO4→K2FeO4,该转化是在某低温下进行的,说明此温度下K2FeO4的溶解度小于Na2FeO4,所以Ksp(K2FeO4)<Ksp(Na2FeO4),
故答案为:<;
(3)①由图1可知,Fe(NO3)3浓度一定,温度在26℃时,K2FeO4的生成率最高,故工业生产中最佳温度为26℃;
由图1可知,Fe(NO3)3浓度在330g/L时,K2FeO4的生成率最高,由图2可知,NaClO在2575g/L时,K2FeO4的生成率最高,所以Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为330g/L:275g/L=6:5,
故答案为:26;6:5;
②由信息可知,碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,根据元素守恒还应生成H2O,反应中FeO42-→FeO43-,铁元素化合价由+6价降低为+5价,总共降低1价,Fe3+→FeO43-,铁元素化合价由+3价升高为+5价,总共升高2价,化合价升降最小公倍数为2,所以FeO42-系数为2,Fe3+系数为1,根据铁元素守恒确定FeO43-系数为3,根据电荷守恒确定OH-系数8,根据氢元素守恒确定H2O系数为4,反应离子方程式为2FeO42-+Fe3++8OH-=3FeO43-+4H2O,
故答案为:2FeO42-+Fe3++8OH-=3FeO43-+4H2O;
(4)K2FeO4 在水溶液中易水解呈碱性,应选择碱性非水溶液抑制K2FeO4水解,进行洗涤.
A.H2O,不能抑制水解,且容易损失,故A错误;
B.CH3COONa、异丙醇,能抑制水解,减少洗涤损失,故B正确;
C.NH4Cl、异丙醇,不能抑制水解,促进水解,故C错误;
D.Fe(NO3)3、异丙醇,不能抑制水解,促进水解,故D错误;
故答案为:B.
点评 本题考查混合物分离提纯,为高频考点,把握流程中物质的性质、混合物分离方法、习题中信息等为解答该题的关键,侧重于学生的分析能力和实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
. ,该氢化物的水溶液显碱性(填“酸性”、“碱性”或“中性”),该溶液与少量AlCl3溶液反应的离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
,该氢化物的水溶液显碱性(填“酸性”、“碱性”或“中性”),该溶液与少量AlCl3溶液反应的离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的最高价氧化物对应水化物的酸性大于W | |
| B. | Z的气态氢化物的稳定性大于W | |
| C. | YZ和ZW2所含化学键类型相同 | |
| D. | 简单离子半径:r(Y2+)<r(X-)<r(W-)<r(Z2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol任何气体都含有相同的原子数 | |
| B. | 1molO2中含有6.02×1023个氧分子 | |
| C. | 1molH2中含有1mol氢原子和2mol电子 | |
| D. | 1molH2SO4中含有6NA个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com