
| A. | 0.1 mol•L-1 Na2CO3溶液中CO32-、HCO3-和H2CO3总数为0.1 NA | |
| B. | NaCl的沸点为1465℃,1500℃时气体摩尔体积是Vm,此状态下,3Vm L的氯化钠含有3 NA个共价键 | |
| C. | 25℃,1 L pH=1的稀硫酸中含有的H+数为0.1 NA | |
| D. | 1 mol Cu和足量稀硝酸反应产生$\frac{2}{3}$ NA个NO分子 |
分析 A.溶液体积不知微粒数不能计算;
B.1500℃时氯化钠为气体,分子中含一个共价键,物质的量n=$\frac{V}{{V}_{m}}$;
C.1 L pH=1的稀硫酸中氢离子浓度为0.1mol/L,氢离子数=nNA;
D.根据电子守恒计算,1molCu失2mole-,HNO3还原为NO,依据电子守恒计算判断.
解答 解:A.溶液体积不知微粒数不能计算,0.1 mol•L-1 Na2CO3溶液中CO32-、HCO3-和H2CO3总浓度为0.1mol/L,故A错误;
B.1500℃时氯化钠为气体,分子中含一个共价键,此状态下,3Vm L的氯化钠含有3 NA个共价键,故B正确;
C.1 L pH=1的稀硫酸中氢离子浓度为0.1mol/L,氢离子数=1L×0.1mol/L×NA=0.1NA,故C正确;
D.根据电子守恒计算,1molCu失2mole-,HNO3还原为NO,电子转移3e-,所以生成$\frac{2}{3}$molNO,$\frac{2}{3}$NA个NO分子,故D正确;
故选A.
点评 本题考查了盐类水解、溶液中物料守恒、微粒结构、氧化还原反应电子转移守恒等知识点,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | “丹砂(HgS)烧之成水银,积变又还成了丹砂”,该过程发生了氧化还原反应 | |
| B. | 大分子化合物油脂在人体内水解为氨基酸和甘油等小分子才能被吸收 | |
| C. | 利用植物油的氧化反应可以获得人造脂肪 | |
| D. | 干燥剂硅胶和硅橡胶的主要成分都是二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
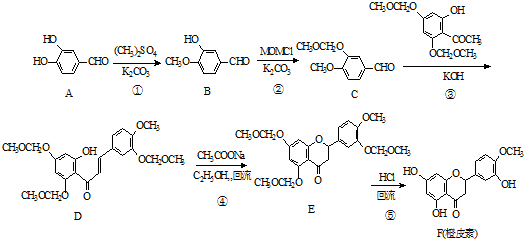
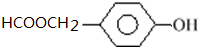 .
. 和CH3CHO为原料制备化合物
和CH3CHO为原料制备化合物  的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | W点所示的溶液中:c(Na+)+c(H+)═2c(CO32-)+c(OH-)+c(Cl-) | |
| B. | pH=4的溶液中:c(H2CO3)+c(HCO32-)+c(CO32-)<0.1 mol•L-1 | |
| C. | pH=8的溶液中:c(H+)+c(H2CO3)+c(HCO3-)═c(OH-)+c(Cl-) | |
| D. | pH=11的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3- )>c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| B. | 干燥剂硅胶和硅橡胶的主要化学成分都是二氧化硅 | |
| C. | 铜制品在潮湿的空气中生锈,其主要原因是发生了析氢腐蚀 | |
| D. | “丹砂(HgS)烧之成水银,积变又还成了丹砂”,该过程发生了分解、化合、氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl的摩尔质量是58.5g | |
| B. | 0.5 mol CO2 中所含的CO2 分子数为 3.01×1023 | |
| C. | 标准状况下,6.02×1022 个CO2 所占的体积约是 22.4 升 | |
| D. | 在 l L 水中溶解5.85g NaCl固体,即可配制得0.1 mo1/L 的NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
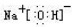 (写电子式,下同),既含有非极性共价键又含有离子键的化合物为
(写电子式,下同),既含有非极性共价键又含有离子键的化合物为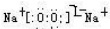 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com