
| A、I2具有氧化性 |
| B、该反应属于氧化还原反应 |
| C、氧化剂是KClO3 |
| D、I2是还原剂 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

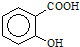 )可导致患者出现头痛、恶心等症状,需静脉注射小苏打(NaHCO3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解.写出水杨酸与小苏打反应的化学方程式
)可导致患者出现头痛、恶心等症状,需静脉注射小苏打(NaHCO3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解.写出水杨酸与小苏打反应的化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3:2 | B、2:1 |
| C、1:2 | D、1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大理石雕像被酸雨腐蚀毁坏 |
| B、充有氢气的气球遇明火爆炸 |
| C、铁制菜刀生锈 |
| D、铜铸塑像上出现铜绿[Cu2 (OH)2CO3] |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当Al3+恰好完全沉淀时,消耗Ba(OH)2 1.5mol |
| B、当SO42-恰好完全沉淀时,Al3+全部转化为AlO2- |
| C、随着加入的Ba(OH)2的物质的量不断增大,沉淀的物质的量不断增大 |
| D、当向溶液中加入1.5mol Ba(OH)2时,反应可用离子方程式2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、①④ | D、③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
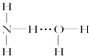
| A、①③ | B、②③ | C、⑤⑥ | D、④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com