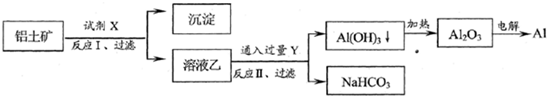
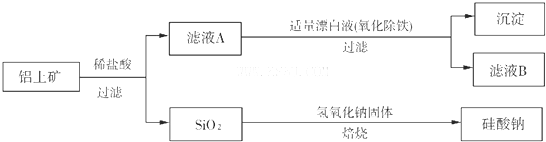
解:(1)氧化铝为两性氧化物,与NaOH反应生成NaAlO
2,SiO
2为酸性氧化物,在加热条件下反应生成Na
2SiO
3,反应后所得滤液中含有偏铝酸钠、硅酸钠以及过量的氢氧化钠,
故答案为:NaOH、NaAl(OH)
4(NaAlO
2)、Na
2SiO
3[或氢氧化钠、铝酸钠(偏铝酸钠)、硅酸钠];
(2)根据反应产物可知,在滤液甲中通入二氧化碳气体,先与NaOH反应生成碳酸钠,后与偏铝酸钠反应生成氢氧化铝,硅酸钠没有反应,
反应的离子方程式分别为:CO
2+2OH
-═CO
32-+H
2O,CO
2+3H
2O+2AlO
2-═2Al(OH)
3↓+2H
2O
-+CO
32-,
故答案为:CO
2+2OH
-═CO
32-+H
2O,CO
2+3H
2O+2AlO
2-═2Al(OH)
3↓+2H
2O
-+CO
32-;
(3)三种混合液中,最先结合 H
+离子的是OH
-离子,由反应Ⅱ可知,AlO
2-离子较SiO
32-离子先结合 H
+离子生成Al(OH)
3,
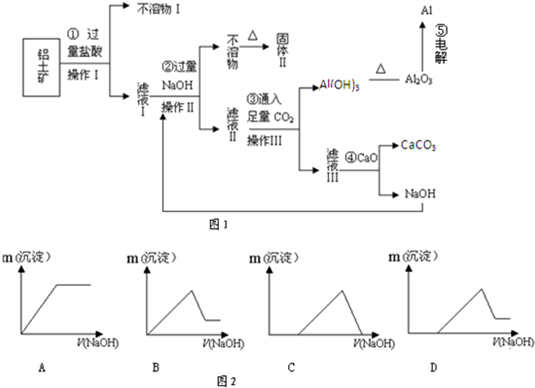
故答案为:bac;
(4)滤液甲中加入过量盐酸反应生成氯化铝,电解时阳极反应为4OH
--4e
-═2H
2O+O
2↑,阴极反应为2H
2O+2e
-═2OH
-+H
2↑,
阴极上还发生Al
3++3OH
-═Al(OH)
3↓、Al(OH)
3+OH
-═AlO
2-+2H
2O 等反应,
故答案为:2H
2O+2e
-═2OH
-+H
2↑;Al(OH)
3+OH
-═Al(OH)
4- 或Al(OH)
3+OH
-═AlO
2-+2H
2O;
(5)电解后溶液中只含有两种等物质的量浓度的碱性溶质,应为NaOH和NaAlO
2溶液,加入盐酸时先后发生反应:OH
-+H
+═H
20,AlO
2-+H
++H
2O═Al(OH)
3↓,Al(OH)
3+3H
+═Al
3++3H
2O,
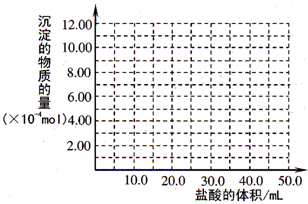
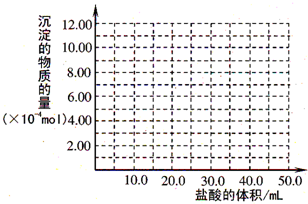
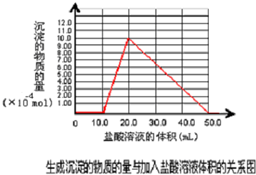
设NaOH为xmol,则所需盐酸为x+x+3x=0.100mol?L
-1×0.05L=0.005mol,x=0.001mol,以此画出图象,
故答案为:
分析:(1)氧化铝为两性氧化物,与NaOH反应生成NaAlO
2,SiO
2为酸性氧化物,在加热条件下反应生成Na
2SiO
3,以此分析反应产物;
(2)根据反应产物可知,在滤液甲中通入二氧化碳气体,先与NaOH反应生成碳酸钠,后与偏铝酸钠反应生成氢氧化铝,硅酸钠没有反应,以此书写反应的离子方程式;
(3)三种混合液中,最先结合 H
+离子的是OH
-离子,由反应Ⅱ可知,AlO
2-离子较SiO
32-离子先结合 H
+离子生成Al(OH)
3;
(4)根据溶液中离子组成和溶液中离子的放电顺序判断反应的离子方程式;
(5)电解后溶液中只含有两种等物质的量浓度的碱性溶质,应为NaOH和NaAlO
2溶液,加入盐酸时先后发生反应:OH
-+H
+═H
20,AlO
2-+H
++H
2O═Al(OH)
3↓,Al(OH)
3+3H
+═Al
3++3H
2O,
设NaOH为xmol,则所需盐酸为x+x+3x=0.100mol?L
-1×0.05L=0.005mol,x=0.001mol,以此画出图象.
点评:本题考查镁和铝的重要化合物,题目难度中等,注意把握物质的重要性质.