
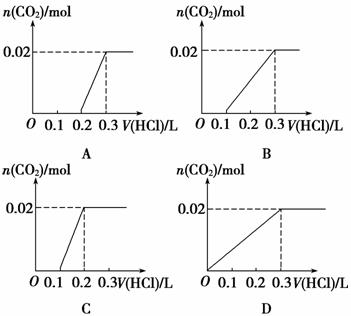
将0.84 g NaHCO3和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是
科目:高中化学 来源: 题型:
对平衡CO2(g)  CO2(aq) .△H=-19.75KJ/mol,为增大二氧化碳气体在
CO2(aq) .△H=-19.75KJ/mol,为增大二氧化碳气体在
水中的溶解度,应采用的方法是 ( )
A、升温增压 B、降温减压 C、升温减压 D、降温增压
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.物质发生化学反应的反应热仅指反应放出的热量
B.热化学方程式中各物质的化学计量数只表示物质的量,不表示分子的个数
C.所有的燃烧都是放热反应
D.热化学方程式中分子式前面的化学计量数可以是分数
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,两圆圈相交的阴影部分表示圆圈内物质相互发生的反应。钠及其氧化物的物质的量均为0.1 mol,水的质量为100 g。下列说法正确的是
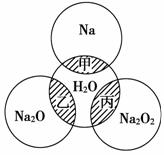
A.甲、乙、丙都属于氧化还原反应
B.甲反应的离子方程式为
Na+2H2O===Na++2OH-+H2↑
C.丙充分反应,能产生0.05 mol O2,电子转移0.1 mol
D.甲、乙、丙充分反应后所得溶液中溶质的质量分数分别为
w1、w2、w3,则:2w1=w2=w3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对于过氧化钠的叙述中,正确的是
A.将少量Na2O2投入紫色石蕊试液中,溶液最终呈蓝色
B.1 mol Na2O2与H2O完全反应,转移2 mol电子
C.充分加热等物质的量的Na2O2和NaHCO3的混合物,剩余物质为Na2CO3
D.a g CO和H2的混合气体充分燃烧的产物与足量的Na2O2充分反应后,固体质量增加a g
查看答案和解析>>
科目:高中化学 来源: 题型:
分别取等物质的量浓度的氢 氧化钠溶液各100 mL,再通入一定量的CO2,随后分别各取20 mL溶液,向其中逐滴滴入0.2 mol·L-1的盐酸,在标准状况下产生CO2的体积(y轴)与所加入盐酸的体积(x轴)的关系如下图(分A、B两种情况):
氧化钠溶液各100 mL,再通入一定量的CO2,随后分别各取20 mL溶液,向其中逐滴滴入0.2 mol·L-1的盐酸,在标准状况下产生CO2的体积(y轴)与所加入盐酸的体积(x轴)的关系如下图(分A、B两种情况):
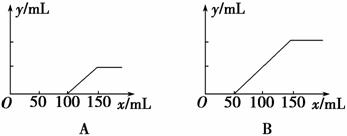
(1)在A情况下,溶质是________(填化学式),其物质的量之比为________。
(2)在B情况下,溶质是________(填化学式),其物质的量之比为________。
(3)原氢氧化钠溶液的物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是( )
A.层析法是分离、提纯和鉴定物质的一种方法
B.层析法可以分为纸上层析、柱层析和薄层层析
C.纸上层析要求被分离物质在流动相溶剂中的溶解度越大越好
D.纸上层析要求被分离物质在流动相溶剂中的溶解度既不能太大也不能太小
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,Na2CO3溶液存在水解平衡:CO +H2O
+H2O HCO
HCO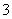 +OH-。下列说法正确的是( )
+OH-。下列说法正确的是( )
A.稀释溶液,水解反应平衡常数增大
B.通入CO2,平衡朝正反应方向移动
C.升高温度,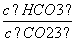 增大
增大
D.加入NaOH固体,溶液pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验原理、方法和结论都正确的是
A.已知Cu2O+2H+===Cu2++Cu+H2O,氢气还原氧化铜后所得红色固体能完全溶于稀硝酸,说明还原产物是铜
B.用蒸馏水、酚酞、BaCl2溶液和已知浓度盐酸标准液作试剂,可测定NaOH固体(杂质仅为Na2CO3)的纯度
C.实验室中的CCl4含有少量溴,加适量的苯,振荡、静置后分液,可除去CCl4中的溴
D.取一定量水垢加盐酸,生成能使澄清石灰水变浑浊的气体,说明水垢的主要成分为CaCO3、MgCO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com