
【题目】现用氯水来制取含有次氯酸的溶液,既要提高溶液中HClO物质的量浓度,又要降低溶液中HCl浓度,下列措施可以采用的是
A. 加热挥发HCl
B. 加水使平衡向正反应方向移动
C. 再通入氯气
D. 加CaCO3中和HCl
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KC1O3和草酸(H2C2O4)在60℃时反应制得。某学生用下图所示的装置模拟工业制取及收集C1O2,其中A为C1O2的发生装置,B为C1O2的凝集装置,C为尾气吸收装置。

请回答下列问题:
(1)A中反应产物有K2CO3、C1O2和CO2等,请写出该反应的化学方程式:________________________。
A部分还应添加温水浴控制温度在60 °C,B部分还应补充什么装置:_________________。
(2)该装置按(1)补充完整后,装置A、B、C中还有一处设计明显不合理的是_____(填“A”“B”或“C”)。
(3)C中的试剂为NaOH溶液,反应时生成氯酸钠和亚氯酸钠(NaClO2),该反应的离子方程式为____________。若实验时需要450 mL 4 mol L-1的NaOH溶液,则在精确配制时,需要称取NaOH的质量是____g,所使用的仪器除托盘天平、量筒、胶头滴管、玻璃棒外,还必须有_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验室模拟以工业用菱铁矿(FeCO3)含碱式碳酸铜[Cu2(OH)2CO3]为原料制取纯净的FeCO3和氯化铜晶体(CuCl2·2H2O)的生产流程如下:
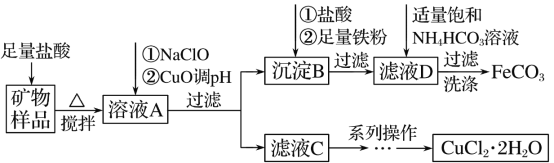
(1)盐酸溶解矿物样品时可能发生的离子方程式______。
(2)写出向溶液A中加入NaClO的离子方程式_________。
(3)向沉淀B中依次加入盐酸和铁粉时可能发生的离子方程式_________。
(4)处理滤液D时,除产生沉淀外,还产生无色气体,写出该反应的离子方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸性溶液中只有Na+、CH3COO﹣、H+、OH﹣四种离子.则下列描述正确的是
A. 该溶液可由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成
B. 该溶液可由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
C. 加入适量NaOH,溶液中离子浓度为c(CH3COO﹣)>c(Na+ )>c(OH﹣)>c(H+)
D. 加入适量氨水,c(CH3COO﹣)一定大于c(Na+)、c(NH4+)之和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向20.00 mL 1.000 mol·L-1氨水中滴入1.000 mol·L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是
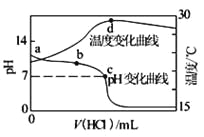
A. 氨水的电离程度a>b>c
B. a、d两点的溶液,水的离子积Kw(a)>Kw(d)
C. c点时消耗盐酸体积V(HCl)<20.00ml
D. d点时溶液温度达到最高,之后温度略有下降,原因是NH3·H2O电离吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色工业废水中可能含有Na+、Mg2+、Al3+、Cl-、SO42-中的几种离子。
a.取少许该废水于试管中,加入足量的Ba(NO3)2溶液和稀硝酸,产生白色沉淀,充分反应后过滤,向滤液中加入AgNO3溶液无沉淀产生。
b.另取10mL该废水于试管中,滴加NaOH溶液先产生白色沉淀,后部分沉淀溶解生成沉淀的物质的量随加入NaOH的物质的量关系如下图所示。
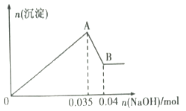
根据上述实验和图中数据:
(1)该废水中一定不含有的离子有________(填离子符号);
(2)A点沉淀的化学式___________________;
(3)写出A→B过程中发生反应的离子方程式:____________________________;
(4)该废水中,c(Al3+)=________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解足量下列溶液一段时间后,再加入一定量括号内的纯净物,能使溶液恢复到原来的成分和浓度的是
A. AgNO3[AgNO3] B. NaOH[NaOH] C. KCl[H2O] D. CuSO4[CuO]
【答案】D
【解析】石墨电极为惰性电极,溶液中阳离子在阴极放电,阴离子在阳极放电。A、电解AgNO3溶液,Ag+在阴极放电生成Ag,OH-在阳极放电生成O2,且n(Ag)∶n(O2)=2∶1,则应加入Ag2O恢复浓度,故A错误;B、电解NaOH溶液,H+在阴极放电生成H2,OH-在阳极放电生成O2,且n(H2)∶n(O2)=2∶1,则应加入一定量的H2O恢复原样,故B错误;C、电解KCl溶液,H+在阴极放电生成H2,Cl-在阳极放电生成Cl2,且n(H2)∶n(Cl2)=1∶1,则应加入一定量HCl恢复原样,故C错误;D、电解CuSO4溶液,Cu2+在阴极放电生成Cu,OH-在阳极放电生成O2,且n(Cu)∶n(O2)=2∶1,则应加入一定量CuO恢复原样,故D正确。故选D。
点睛:分析电解反应的原理,在两极析出什么物质(固体或气体),相当于什么物质脱离反应体系,根据元素守恒和原子比例,加入对应的物质,即可使溶液完全复原。
【题型】单选题
【结束】
28
【题目】工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是
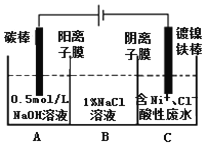
已知:①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A. 碳棒上发生的电极反应:4OH--4e-=O2↑+2H2O
B. 电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C. 为了提高Ni的产率,电解过程中需要控制废水pH
D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁均为中学化学常见的纯净物,它们之间有如图所示的反应关系。下列物质组不满足上述转化关系的是( )
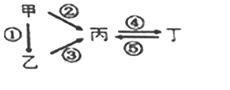
选项 | 甲 | 乙 | 丙 | 丁 |
A | N2 | NH3 | NO | NO2 |
B | Si | SiO2 | Na2SiO3 | Na2CO3 |
C | S | H2S | SO3 | H2SO4 |
D | Al | Al2O3 | NaAlO2 | Al(OH)3 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式中或电离方程式正确的是
A. Fe2(SO4)3溶液中加入足量Ba(OH)2溶液:Fe3++SO42-+Ba2++3OH-=Fe(OH)3↓+BaSO4↓
B. 向NaHSO4溶液中加入Ba(OH)2溶液至SO42-完全沉淀: 2H++SO42-+2OH-+Ba2+=2H2O+BaSO4↓
C. 向碳酸氢钙溶液中加入过量氢氧化钠:Ca2++HCO3-+OH-=CaCO3↓+H2O
D. HSO3-在水中的电离:HSO3-+H2O![]() SO32-+ H3O+
SO32-+ H3O+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com