
分析 (1)①依据热化学方程式和盖斯定律计算得到NO2与SO2反应生成SO3(g)和NO的热化学方程式;
②a.随反应:NO2(g)+SO2(g)?SO3(g)+NO(g)的进行,气体的总的物质的量不变,压强不变.
b.混合气体颜色保持不变,说明二氧化氮的浓度不变.
c.化学方程式分析可知随反应进行NO和SO3的物质的量之比不变;
d.每消耗1mol SO2的同时生成1mol NO2表示正逆反应速率相同;
(2)①2min时测得生成CH3OH 0.2mol,依据反应速率概念计算得到甲醇的反应速率,反应速率之比等于化学方程式计量数之比计算得到氢气表示的反应速率;
②平衡后将容器的容积压缩到原来的$\frac{1}{2}$,压强增大,正、逆反应速率都增大,但正反应速率增大更多,平衡向正反应方向移动,生成物的浓度增大,由于温度不变,则平衡常数不变,结合平衡常数可知,平衡时反应物各组分的浓度都增大,据此分析解答;
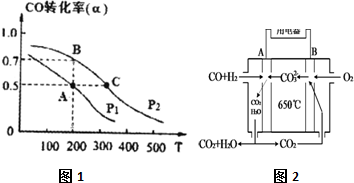
(3)①温度越高反应速率越快所需时间越短.
②温度不变,平衡常数不变,根据A点温度下的转化率求平衡时各种物质的浓度;
(4)碳酸盐燃料电池中通氧气的电极一定为正极,通入燃料的电极A一定为负极,氧气在B电极上发生还原反应,根据图知,A电极上失电子发生氧化反应生成水和二氧化碳;B电极上氧气得到电子和二氧化碳生成碳酸根离子.
解答 解:(1)①已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1 ①
2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ•mol-1 ②
依据盖斯定律计算①-②得到NO2与SO2反应生成SO3(g)和NO的热化学方程式NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8 kJ•mol-1,
故答案为:NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8 kJ•mol-1;
②a.随反应进行,气体的物质的量不变,压强不变,体系压强保持不变,不能说明到达平衡状态,故a错误;
b.混合气体颜色保持不变,说明二氧化氮的浓度不变,说明到达平衡状态,故b正确;
c.随反应进行NO和SO3的物质的量之比不发生变化,物质的量之比保持不变,反应自始至终都按此比例进行,不能说明到达平衡状态,故c错误;
d.每消耗1mol SO2的同时生成1mol NO2都表示正逆反应速率相同,故d正确;
故答案为:bd;
(2)①2min时测得生成CH3OH 0.2mol,V(CH3OH)=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol/L•min,反应速率之比等于化学方程式计量数之比,则0~2min的平均反应速率v(H2)=2V(CH3OH)=2×0.05mol/L•min=0.1mol•L-1•min-1,
故答案为:0.1mol•L-1•min-1;
②a.平衡后将容器的容积压缩到原来的$\frac{1}{2}$,压强增大,平衡向正反应方向移动,生成物的浓度增大,由于平衡常数不变,结合平衡常数可知,平衡时反应物各组分的浓度都增大,故a错误;
b.压强增大,正、逆反应速率都增大,但正反应速率增大更多,故b错误;
c.压强增大,平衡向正反应方向移动,CH3OH 的物质的量增加,故c正确;
d.压强增大,平衡向正反应方向移动,氢气的物质的量减小、甲醇的物质的量增大,故重新平衡$\frac{c({H}_{2})}{c(C{H}_{3}OH)}$减小,故d正确;
故答案为:cd;
(3)①由图可知A点低于C的温度,温度越高反应速率越快所需时间越短,所以tA>tC,故答案为:>;
②CO(g)+2H2(g)?CH3OH(g)
初起浓度 1mol/L 2mol/L 0
变化量 0.5mol/L 1mol/L 0.5mol/L
平衡量 0.5mol/L 1mol/L 0.5mol/L
故K=$\frac{0.5mol/L}{0.5mol/L×(1mol/L)^{2}}$=1L2mol-2,
图象可知BC点是不同温度下的平衡,温度升高CO的转化率减小,说明正反应为放热反应,升温平衡逆向进行,平衡常数减小,则KC<KB,
故答案为:1;<;
(4)根据图知,A电极上失电子发生氧化反应生成水和二氧化碳,所以A是负极,B电极上氧气得到电子和二氧化碳生成碳酸根离子,电极反应式为O2+4e-+2CO2═2CO32-;
故答案为:负;O2+4e-+2CO2═2CO32-.
点评 本题考查热化学方程式书写、化学平衡图象、影响化学平衡因素、平衡常数与反应速率计算、原电池原理等,掌握基础是解本题的关键,题目难度中等.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入硝酸酸化,再滴加KSCN溶液后有红色物质生成,则原溶液中一定有Fe3+存在 | |
| B. | 加入盐酸有能使澄清石灰水变浑浊的气体生成,则原溶液中一定有大量的CO32-存在 | |
| C. | 用某溶液做焰色反应实验时火焰为黄色,则该溶液中一定有钠元素,可能有钾元素 | |
| D. | 分别含有Mg2+、Fe3+、Al3+、Cu2+、Fe2+和Na+的六种盐溶液,只用NaOH溶液是不能一次鉴别开的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的裂化、裂解和煤的干馏都是化学变化 | |
| B. | 苯和浓溴水在溴化铁作催化剂的条件下反应生成溴苯 | |
| C. | 制备聚苯乙烯和制备酚醛树脂的反应均属于加聚反应 | |
| D. | 淀粉、油脂和蛋白质都是高分子化合物,都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 至少存在5种离子 | |
| B. | SO42ˉ、NH4+一定存在,Clˉ可能不存在 | |
| C. | Clˉ一定存在,且c(Clˉ)≥0.3mol/L | |
| D. | CO32ˉ、Al3+一定不存在,K+可能存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
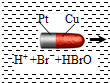 一种子弹头形的纳米铜铂电池,它在稀溴水中能沿着铜极方向移动(如图),电池反应为:Cu+Br2=CuBr2.下列说法正确的是( )
一种子弹头形的纳米铜铂电池,它在稀溴水中能沿着铜极方向移动(如图),电池反应为:Cu+Br2=CuBr2.下列说法正确的是( )| A. | 铜为电池的正极 | |
| B. | 铂不断溶解 | |
| C. | 稀溴水为电解质溶液 | |
| D. | 电池工作时实现机械能向电能再向化学能转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
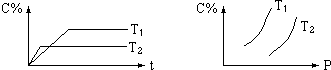
| A. | T1<T2 | B. | m+n<e | ||
| C. | 正反应是吸热反应 | D. | 逆反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在甲苯中加入少量酸性高锰酸钾溶液,振荡后褪色,正确的解释是由于侧链与苯环的相互影响,使侧链和苯环均易被氧化 | |
| B. | 等质量的乙烷、乙烯、乙炔在氧气中完全燃烧,乙烷消耗的氧气最多 | |
| C. | 间二溴苯仅有一种空间结构可证明苯分子中不存在单双键交替的结构 | |
| D. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com