
 常温下,HNO2的电离平衡常数为K=4.6×10-4(已知$\sqrt{4.6}$=2.14),向20mL0.01mol•L-1的HNO2溶液中逐滴加入相同浓度的NaOH溶液,测得混合液的pH随NaOH溶液体积的变化如图所示,下列判断正确的是( )
常温下,HNO2的电离平衡常数为K=4.6×10-4(已知$\sqrt{4.6}$=2.14),向20mL0.01mol•L-1的HNO2溶液中逐滴加入相同浓度的NaOH溶液,测得混合液的pH随NaOH溶液体积的变化如图所示,下列判断正确的是( )| A. | HNO2的电离方程式为HNO2=NO2-+H+ | |
| B. | a点H2O电离出的c(H+)=2.14×10-3mol•L-1 | |
| C. | b点溶液中离子浓度大小关系为c(NO2-)>c(Na+)>c(H+)>c(OH-) | |
| D. | X值等于20 |
分析 A.亚硝酸为弱酸存在电离平衡,电离方程式用可逆号;
B.由HNO2?H++NO2-,K=$\frac{c({H}^{+})c(N{{O}_{2}}^{-})}{c(HN{O}_{2})}$≈$\frac{{c}^{2}({H}^{+})}{c(HN{O}_{2})}$,4.6×10-4≈$\frac{{c}^{2}({H}^{+})}{0.01}$,得到c(H+)=2.14×10-3mol/L;
C.b点溶液为HNO2、NaNO2混合溶液,且浓度比为1:1;由NO2-+H2O?HNO2+OH-,HNO2?H++NO2-,电离程度大于水解程度,可知溶液呈酸性;
D.向20mL0.01mol•L-1的HNO2溶液中逐滴加入相同浓度的NaOH溶液,若恰好反应需要氢氧化钠溶液体积20,ml,C点是溶液呈中性,溶质为HNO2、NaNO2混合溶液.
解答 解:A.HNO2的电离平衡常数为K=4.6×10-4,亚硝酸为弱酸存在电离平衡,电离方程式为HNO2?NO2-+H+,故A错误;
B.由HNO2?H++NO2-,K=$\frac{c({H}^{+})c(N{{O}_{2}}^{-})}{c(HN{O}_{2})}$≈$\frac{{c}^{2}({H}^{+})}{c(HN{O}_{2})}$,4.6×10-4≈$\frac{{c}^{2}({H}^{+})}{0.01}$,得到c(H+)=2.14×10-3mol/L,水电离出氢离子浓度远小于酸电离出氢离子,故B错误;
C.b点溶液为HNO2、NaNO2混合溶液,且浓度比为1:1;由NO2-+H2O?HNO2+OH-,HNO2?H++NO2-,电离程度大于水解程度,可知溶液呈酸性,离子浓度大小为c(NO2-)>c(Na+)>c(H+)>c(OH-),故C正确;
D.向20mL0.01mol•L-1的HNO2溶液中逐滴加入相同浓度的NaOH溶液,若恰好反应需要氢氧化钠溶液体积20,ml,C点是溶液呈中性,溶质为HNO2、NaNO2混合溶液,X<20ml,故D错误;
故选C.
点评 本题考查了弱电解质电离平衡、离子浓度大小比较、平衡常数计算、图象变化分析判断,注意中性溶液中溶质的判断,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | H2S沸点比H2O高 | B. | NH3和CO2均属于弱电解质 | ||
| C. | NH3(l)气化为NH3(g)放出热量 | D. | HCOOH能与NH4HCO3反应放出CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类、油脂、蛋白质都是高分子化合物 | |
| B. | 淀粉遇碘溶液变蓝 | |
| C. | 正丁烷和异丁烷互为同分异构体 | |
| D. | 天然气的主要成分是甲烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
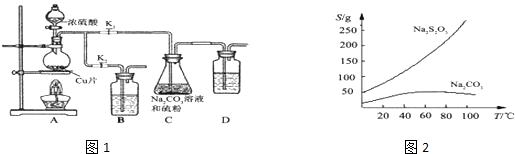
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂、纤维素和蛋白质均能发生水解,且最终水解产物均不相同 | |
| B. | 酒精浓度过高或过低都不利于杀菌消毒,医用酒精中乙醇的质量分数为75% | |
| C. | 鸡蛋清和淀粉溶液都属于胶体,遇到硫酸铜溶液可以发生胶体聚沉 | |
| D. | 纤维素可以加强肠胃蠕动,有助于消化,因此纤维素是人体的营养物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | HA(A代表某种酸根) | HNO2 | H2CO3 |
| Ka | Ka=4.9×10-10 | Ka=4.6×10-4 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
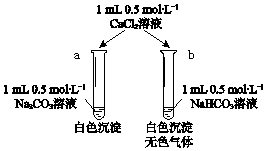
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
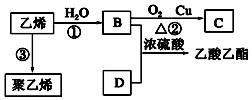 已知乙烯能发生以下转化:
已知乙烯能发生以下转化: ,列举聚乙烯的一种用途制塑料.
,列举聚乙烯的一种用途制塑料.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com