
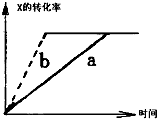
 图中a曲线表示一定条件下可逆反应:X(g)+Y(g)═2Z(g)+W(S)△H<0的反应过程.若使a曲线变为b曲线,可采用的措施是( )
图中a曲线表示一定条件下可逆反应:X(g)+Y(g)═2Z(g)+W(S)△H<0的反应过程.若使a曲线变为b曲线,可采用的措施是( )

科目:高中化学 来源: 题型:
 (2011?大兴区二模)短周期元素A、B、C、D、E、F、G其核外电子总数依次增多,A原子是元素中电子总数最少的,B的最外层电子数是次外层电子数的二倍,C最外层电子数是其电子层数的三倍,G与C同族且两元素核外电子总数之和与D、E两元素核外电子总数之和相等,F的最外电子数是次外层电子数的二分之一.
(2011?大兴区二模)短周期元素A、B、C、D、E、F、G其核外电子总数依次增多,A原子是元素中电子总数最少的,B的最外层电子数是次外层电子数的二倍,C最外层电子数是其电子层数的三倍,G与C同族且两元素核外电子总数之和与D、E两元素核外电子总数之和相等,F的最外电子数是次外层电子数的二分之一.

查看答案和解析>>
科目:高中化学 来源: 题型:
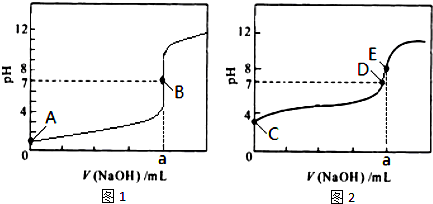
查看答案和解析>>
科目:高中化学 来源: 题型:
 CH3OH(g).图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化.
CH3OH(g).图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化.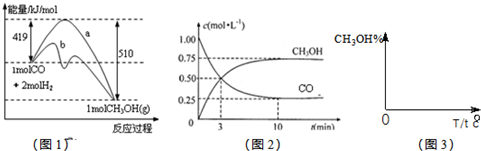
 CH3OH(g)的平衡常数为
CH3OH(g)的平衡常数为查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 通电 |
| 一定条件 |
| c4(NH3)?c3(O2) |
| c2(N2)?c6(H2O) |
| c4(NH3)?c3(O2) |
| c2(N2)?c6(H2O) |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com