
分析 X原子核外的M层中只有两对成对电子,核外电子排布应为1s22s22p63s23p4,为S元素,Y原子核外的L层电子数是K层的两倍,Y有2个电子层,最外层电子数为4,故Y为C元素,Z是地壳内含量最高的元素,为O元素,Q的核电荷数是X与Z的核电荷数之和,原子序数为24,为Cr元素,E在元素周期表的各元素中电负性最大,应为F元素,结合元素对应单质、化合物的结构和性质解答该题.
解答 解:X原子核外的M层中只有两对成对电子,核外电子排布应为1s22s22p63s23p4,为S元素,Y原子核外的L层电子数是K层的两倍,Y有2个电子层,最外层电子数为4,故Y为C元素,Z是地壳内含量最高的元素,为O元素,Q的核电荷数是X与Z的核电荷数之和,原子序数为24,为Cr元素,E在元素周期表的各元素中电负性最大,应为F元素.
(1)由以上分析可知,X为S,Y为C,故答案为:S;C;
(2)SO2中,S和O形成2个δ键,有1个孤电子对,为V形,CO2中,C和O形成2个δ键,没有孤电子对,为直线形.SO2是极性分子,H2O也是极性分子,相似相溶,而CO2是非极性分子,故SO2在水中溶解度更大,故答案为:V形;直线形;SO2;SO2是极性分子,H2O也是极性分子,相似相溶,而CO2是非极性分子;
(3)Q为Cr,原子序数为24,核外电子排布式为1s22s22p63s23p63d54s1,位于周期表第四周期ⅥB族,最高化合价为+6价,
故答案为:Cr;四;+6.
(4)HF溶液中存在的所有氢键:F-H…F、F-H…O、O-H…F、O-H…O,
故答案为:F-H…F、F-H…O、O-H…F、O-H…O.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、分子结构与性质、氢键等,推断元素的种类是关键,注意把握原子核外电子排布,掌握空间构型的判断.


科目:高中化学 来源: 题型:选择题
| A. | 若1mol A2和1 mol B2的总能量之和大于生成的1 mol AB的总能量,则反应放热 | |
| B. | 若1mol A2和1 mol B2的总能量之和小于生成的2 mol AB的总能量,则反应放热 | |
| C. | 若该反应为放热反应,则Q1+Q2<2Q3 | |
| D. | 若该反应为吸热反应,则Q1+Q2<Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳的比例模型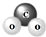 | |
| B. | 原子核内有10个中子的原子:${\;}_{8}^{16}$C | |
| C. | Fe3+的最外层电子排布式为3s23p63d5 | |
| D. | Cu基态的外围电子排布图: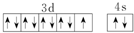 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
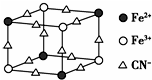
| A. | 该晶体属于离子晶体,M呈+2价 | |
| B. | 该晶体属于分子晶体,化学式为MFe2(CN)6 | |
| C. | 该晶体中与每个Fe3+距离相等且最近的CN-为12个 | |
| D. | 该晶体的一个晶胞中含有的M+的个数为4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
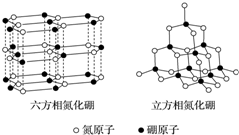 氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.关于这两种晶体的说法,正确的是( )
氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.关于这两种晶体的说法,正确的是( )| A. | 六方相氮化硼与石墨一样可以导电 | |
| B. | 立方相氮化硼含有σ键和π键,所以硬度大 | |
| C. | 两种晶体均为分子晶体 | |
| D. | 六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为平面三角形 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
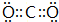 ,B与D形成的原子个数比为1:1的化合物乙的电子式是
,B与D形成的原子个数比为1:1的化合物乙的电子式是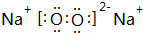 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性:Z->Y2- | B. | 原子半径:W>X>Y>Z | ||
| C. | 离子半径:Y2->Z->X+>W3+ | D. | 原子序数d>c>b>a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正丁烷与异丁烷 | B. | 白磷和红磷 | ||
| C. | ${\;}_{1}^{1}$H2和${\;}_{1}^{2}$H2 | D. | H2O与H2O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com