
【题目】碳酸钠是一种重要的化工原料,主要采用氨碱法生产。回答下列问题:
(1)碳酸钠俗称________,可作为碱使用的原因是___________(用离子方程式表示)。
(2)已知:①2NaOH(s)+CO2(g)=Na2CO3(s)+H2O(g) ΔH1=127.4 kJ·mol1
②NaOH(s)+CO2(g)= NaHCO3(s) ΔH1=131.5 kJ·mol1
反应2NaHCO3 (s)= Na2CO3(s)+ H2O(g) +CO2(g)的ΔH=_______ kJ·mol1,该反应的平衡常数表达式K=________。
(3)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中![]() =_____________(保留三位有效数字)。已知Ksp(BaCO3)=2.6×109,Ksp(BaSO4)=1.1×1010。
=_____________(保留三位有效数字)。已知Ksp(BaCO3)=2.6×109,Ksp(BaSO4)=1.1×1010。
(4)已知室温时,Ksp[Mg(OH)2]=4.0×1011。在0.1 mol/L的MgCl2溶液中,逐滴加入NaOH溶液,当Mg2+完全沉淀时,溶液的pH是_____________(已知lg2=0.3) 。
【答案】 纯碱或苏打 CO32-+H2OHCO3-+OH- +135.6 c(H2O)﹒c(CO2) 23.6 11.3
【解析】(1)碳酸钠俗称纯碱或苏打;Na2CO3为强碱弱酸盐,CO32-离子水解方程式为CO32-+H2OHCO3-+OH-,使溶液呈碱性,故答案为:纯碱或苏打;CO32-+H2OHCO3-+OH-;
(2)①2NaOH(s)+CO2(g)═Na2CO3(s)+H2O(g)△H1=-127.4kJmol-1,②NaOH(s)+CO2(g)═NaHCO3(s)△H1=-131.5kJmol-1,①-2×②得,2NaHCO3(s)═Na2CO3(s)+H2O(g)+CO2(g)△H=+135.6kJmol-1;K=c(H2O)c(CO2),故答案为:+135.6;c(H2O)c(CO2);
(3)Ksp(BaSO4)=c(Ba2+)c(SO42-)=1.1×10-10;Ksp(BaCO3)=c(Ba2+)c(CO32-)=2.6×10-9,所以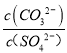 =
=![]() =
=![]() =
=![]() =23.6,故答案为:23.6;
=23.6,故答案为:23.6;
(4)已知c(MgCl2)=0.1molL-1,逐滴加入NaOH溶液,当Mg2+完全沉淀时,c(Mg2+)=10-5 mol/L,即Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-),故c(OH-)=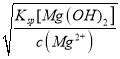 =
=![]() =2×10-3,Kw=1.0×10-14,故c(H+)=
=2×10-3,Kw=1.0×10-14,故c(H+)=![]() =
=![]() ×10-11,pH=11.3,故答案为:11.3。
×10-11,pH=11.3,故答案为:11.3。


科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 构成纤维素、淀粉等大分子的单体为果糖
B. 脂肪是生命活动的主要能源物质
C. 抗体的本质为蛋白质,起免疫作用
D. 人体组织细胞中共含有5种核苷酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】节能减排可以改善环境质量。下述做法正确的是( )
A. 以煤作为主要生活燃料 B. 利用太阳能、风能等替代化石能源
C. 鼓励人们购买和使用汽车 D. 大量使用含磷洗衣粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】17克NH3共有mol原子,0.1molH2S共有个氢原子;同质量的NH3和H2S中分子个数比为 . 在标准状况下,35.5g氯气的体积是 L,将其与氢气完全化合,需氢气的物质的量是mol,将生成的气体配制成1L溶液,溶质的物质的量浓度是molL﹣1 , 将此溶液取出20mL加蒸馏水制成200mL溶液,此冲稀后溶液中溶质的物质的量浓度是molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 化学反应中需要加热的反应一定是吸热反应
B. 化学反应中不需要加热的反应一定是放热反应
C. 熵增加且吸热的反应一定是自发反应
D. 化学反应总是伴随着物质变化和能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两个装置,下列说法错误的是

甲 乙
A.甲、乙装置中,Zn的质量均减小
B.甲、乙装置中,Cu上均有气泡产生
C.化学反应速率:乙>甲
D.甲装置中H+移向Zn,乙装置中H+移向Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生要提纯混有泥沙的食盐,他设计的主要操作有:溶解、过滤、蒸发。在这三次操作中每次都需使用的器具是 ( )
A.烧杯B.漏斗C.玻璃棒D.酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)对金属制品进行抗腐蚀处理,可延长其使用寿命。

①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是____________(用离子方程式表示)。为将碱洗槽液中的铝以沉淀的形式回收,最好向槽液中加入下列试剂中的________。
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为____________________。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极材料的原因是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com