
【题目】有机物的分子式为C6H12N4,分子中每个N原子分别与三个C原子键合,而每个C原子分别与两个N原子键合。分子中没有C=C双键和C-C单键。试写出该有机物的结构简式___;该分子中有___个六元环;每个六元环占有___个氮原子。
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列说法不正确的是( )
A.常温下,18gH2O中电子数均为10NA
B.标准状况下,2molSO2和1molO2充分反应生成SO2的数目为2NA
C.常温下,1L1mol·L-1Na2CO3溶液中,阴离子数目大于NA
D.1molCl2与FeCl2溶液完全与反应,转移电子的数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中(容积为5L),充入氨气和氧气,使其物质的量之比为1∶2,并发生如下反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),此反应在一定条件下进行2min后,测得NH3的物质的量为2mol,NH3的转化率为20%。
4NO(g)+6H2O(g),此反应在一定条件下进行2min后,测得NH3的物质的量为2mol,NH3的转化率为20%。
(1)以NO的浓度变化表示该反应的平均反应速率是________。
(2)O2在2min时的浓度是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知五种元素的原子序数的大小顺序为C>A>B>D>E;A、C同周期,B、C同主族,A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子分子。试回答下列问题:
(1)写出五种元素名称:A_______B________C________D_______E______
(2)用电子式表示离子化合物A2B的形成过程:_____________________
(3)写出下列物质的化学式、电子式或结构式:
①D元素形成的单质的结构式___________
②E和B形成化合物的电子式___________、___________
③A、B、E形成的化合物的化学式为________
④D、E形成的化合物空间结构型为________形_________性分子
⑤D、C、E形成的化合物的化学式为____________
⑥D、E形成的化合物为______化合物,(填“离子”或“共价”)包含的化学键为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸汞和碘化钾溶液混合后会生成红色的碘化汞沉淀,为了探究硝酸汞和碘化钾溶液之间能否发生氧化还原反应,研究人员设计了如图的实验装置,结果电流计指针发生了偏转,下列分析正确的是( )
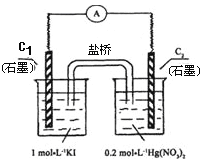
A.如图装置的电流方向是从C1到C2
B.C1是负极,发生的反应是2I-=I2+2e-
C.K+离子向C1电极流动
D.装置发生的总反应是Hg2++2I-=HgI2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A,B,C,D,E五种元素,其中A,B,C,D为短周期元素,A元素的周期数、主族数、原子序数相同;B原子核外有3种能量不同的原子轨道且每种轨道中的电子数相同;C原子的价电子构型为csccpc+1,D元素的原子最外层电子数比次外层电子数少2个,D的阴离子与E的阳离子电子层结构相同,D和E可形成化合物E2D.
(1)上述元素中,第一电离能最小的元素的原子结构示意图为__;D的价电子排布图为__;
(2)下列分子结构图中的●和○表示上述元素的原子中除去最外层电子的剩余部分,小黑点表示没有形成共价键的最外层电子,短线表示共价键.
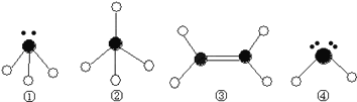
则在以上分子中,中心原子采用sp3杂化形成化学键的是__(填写分子的化学式); 在③的分子中有__个σ键和__个π键.
(3)A,C,D可形成既具有离子键又具有共价键的化合物,其化学式可能为__;足量的C的氢化物水溶液与CuSO4溶液反应生成的配合物,其化学式为__,请说出该配合物中中心原子与配位体及内界与外界之间的成键情况:__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氢氧化铁受热分解化学方程式:___。
(2)Al(OH)3与NaOH溶液反应的离子方程式:___。
(3)铁溶于盐酸的离子方程式:___。
(4)Na2O2与CO2反应的化学方程式:___。
(5)乙烯的结构式:___。
(6)乙烯的电子式:___。
(7)Na2O2的电子式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种短周期元素的原子半径及主要化合价如下表:已知X是短周期中最活泼的金属,且与R同周期。(请用化学用语答题)
元素代号 | X | Y | Z | M | R |
原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
主要化合价 | +1 | +6 -2 | +5 -3 | -2 | +3 |
(1)R的元素符号为___,M在元素周期表中的位置为___。
(2)X与Y按原子个数比1∶1构成的物质的电子式为___,所含化学键类型___。
(3)X+、Y2-、M2-离子半径大小顺序为___。
(4)将YM2通入FeCl3溶液中的离子方程式:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com