
| A. | 150mL 1mol/L的AlCl3 | B. | 75mL 2mol/L的Al(NO3)3 | ||
| C. | 50mL 3mol/L的AlCl3 | D. | 50mL 3mol/L的AlBr3 |
分析 50mL1mol/L的Al2(SO4)3溶液中的Al3+物质的量浓度为1mol/L×2=2mol/L,与溶液体积无关,据此分析.
解答 解:50mL1mol/L的Al2(SO4)3溶液中的Al3+物质的量浓度为1mol/L×2=2mol/L.
A、150mL1mol/L的AlCl3中Al3+物质的量浓度为1mol/L×1=1mol/L,与溶液体积无关,故A错误;
B、75mL 2mol/L的Al(NO3)3溶液中Al3+物质的量浓度为2mol/L×1=2mol/L,与溶液体积无关,故B正确;
C、50mL 3mol/L的AlCl3中Al3+物质的量浓度为3mol/L×1=3mol/L,与溶液体积无关,故C错误;
D、50mL 3mol/L的AlBr3中Al3+物质的量浓度为3mol/L×1=3mol/L,与溶液体积无关,故D错误;
故选B.
点评 本题考查物质的量浓度有关计算,比较基础,有利于基础知识的巩固.


科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
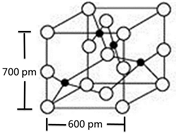 X、Y、M、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;M是周期表中电负性最大的元素;Z基态原子的M层是K层电子数的3倍;R2+离子的3d轨道中有9个电子.请回答下列问题:
X、Y、M、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;M是周期表中电负性最大的元素;Z基态原子的M层是K层电子数的3倍;R2+离子的3d轨道中有9个电子.请回答下列问题: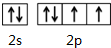 ;Z所在周期中第一电离能最大的主族元素是氯(元素名称)
;Z所在周期中第一电离能最大的主族元素是氯(元素名称)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
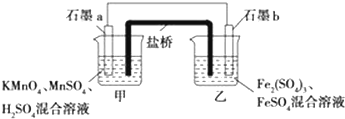
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
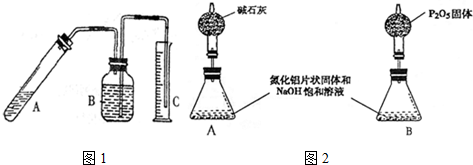
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com