
【题目】已知:常温下,![]()
![]() ,
,![]() ,某二元酸
,某二元酸![]() 及其钠盐的溶液中,
及其钠盐的溶液中,![]() 、
、![]() 、
、![]() 分别在三者所占的物质的量分数
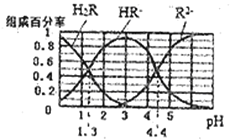
分别在三者所占的物质的量分数![]() 随溶液pH变化关系如图所示,下列叙述错误的是
随溶液pH变化关系如图所示,下列叙述错误的是
A.在![]() 的溶液中:
的溶液中:![]()
B.等体积等浓度的NaOH溶液与![]() 溶液混合后,溶液中水的电离程度比纯水小
溶液混合后,溶液中水的电离程度比纯水小
C.在![]() 的溶液中存在
的溶液中存在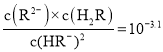
D.向![]() 溶液中加入少量
溶液中加入少量![]() 溶液,发生反应:
溶液,发生反应:![]()
【答案】D
【解析】
据图可知,在二元酸H2A及其钠盐的溶液中,随着pH的增大,H2A的物质的量分数逐渐减小,HA-的物质的量分数先增大后减小,A2-的物质的量分数逐渐增大。pH=1.3时, c(H2A)=c(HA-),![]()
![]() =c(H+)=10-1.3;pH=4.4时,c(HA-)=c(A2-),
=c(H+)=10-1.3;pH=4.4时,c(HA-)=c(A2-),![]() =c(H+)=10-4.4;Ka1
=c(H+)=10-4.4;Ka1![]() Ka2>10-14,所以HA-电离>水解,NaHR溶液显酸性。根据以上认识,结合其它电解质溶液知识可解答各小题。
Ka2>10-14,所以HA-电离>水解,NaHR溶液显酸性。根据以上认识,结合其它电解质溶液知识可解答各小题。
![]() 在
在![]() 的溶液中,
的溶液中,![]() ,溶液中电荷守恒为:
,溶液中电荷守恒为:![]() ,所以
,所以![]() ,故A正确;
,故A正确;
B. 等体积等浓度的NaOH溶液与![]() 溶液混合后,生成NaHR,溶液显酸性,HA-电离>水解,水的电离受到抑制,所以溶液中水的电离程度比纯水小,故B正确;
溶液混合后,生成NaHR,溶液显酸性,HA-电离>水解,水的电离受到抑制,所以溶液中水的电离程度比纯水小,故B正确;
C. 当溶液![]() 时,
时,![]() ,则
,则 ,溶液的
,溶液的![]() 时,
时,![]() ,则
,则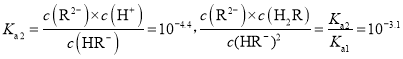 ,故C正确;
,故C正确;
D. 由C选项分析可知,![]() 的电离常数
的电离常数![]() 大于
大于![]() 的
的![]() ,即酸性:
,即酸性:![]() ,所以向
,所以向![]() 溶液中加入少量
溶液中加入少量![]() 溶液,发生反应:
溶液,发生反应:![]() ,故D错误;
,故D错误;
答案选D


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知在25 ℃、101 kPa下,1 g C8H18(辛烷)燃烧生成二氧化碳和液态水放出48.40 kJ热量,表示上述反应的热化学方程式正确的是( )
A. C8H18(l) + O2(g)![]() 8CO2(g) + 9H2O(l) ΔH=-48.40 kJ·mol-1
8CO2(g) + 9H2O(l) ΔH=-48.40 kJ·mol-1
B. C8H18(l) + O2(g)![]() 8CO2(g) + 9H2O(l) ΔH=-5 518 kJ·mol-1
8CO2(g) + 9H2O(l) ΔH=-5 518 kJ·mol-1
C. C8H18(l) + O2(g)![]() 8CO2(g) + 9H2O(l) ΔH=+5 518 kJ·mol-1
8CO2(g) + 9H2O(l) ΔH=+5 518 kJ·mol-1
D. C8H18(l) + O2(g)![]() 8CO2(g) + 9H2O(l) ΔH=+48.40 kJ·mol-1
8CO2(g) + 9H2O(l) ΔH=+48.40 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向一定体积![]() 醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中
醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中![]()
![]() 与pH的变化关系如图所示,则
与pH的变化关系如图所示,则
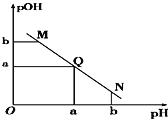
A.M点所示溶液导电能力强于Q点
B.N点所示溶液中![]()
C.M点和N点所示溶液中水的电离程度不相同
D.Q点消耗NaOH溶液的体积小于醋酸溶液的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是合成二氢荆芥内酯的重要原料,其结构简式为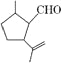 ,下列检验其中官能团的试剂和顺序正确的是
,下列检验其中官能团的试剂和顺序正确的是
A、先加酸性高锰酸钾溶液,后加银氨溶液,微热
B、先加溴水,后加酸性高锰酸钾溶液
C、先加新制氢氧化铜,微热,再加入溴水
D、先加入银氨溶液,微热,酸化后再加溴水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向碳酸溶液中滴加NaOH溶液,测得碳酸中含碳微粒的物质的量分数随pH变化如下图所示,下列说法不正确的是
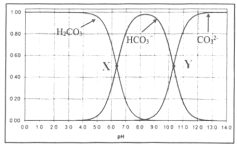
A.人体血液的![]() ,其中含碳微粒以
,其中含碳微粒以![]() 、
、![]() 为主
为主
B.除去NaCl溶液中![]() 的方法是向其中加入盐酸至
的方法是向其中加入盐酸至![]()
C.![]() 的溶液中
的溶液中![]()
![]()
D.将![]() 通入NaOH溶液制取
通入NaOH溶液制取![]() ,应大约控制
,应大约控制![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH 溶液,分别滴定等体积且浓度均为0.1mol/L的三种酸(HA、HB 和HD)溶液,滴定的曲线如图所示,下列判断正确的是
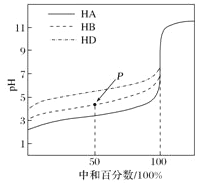
A. 三种酸的电离常数关系:K(HD)>K(HB)>K(HA)
B. pH=7 时,三种溶液中:c(A-)=c(B-)=c(D-)
C. 当三种酸中和百分数达100%时,离子总浓度最大的是NaD 溶液
D. 滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下反应2AB(g)![]() A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是
A. 单位时间内生成nmolA2,同时消耗2n molAB
B. 容器内,3种气体AB、A2、B2共存
C. AB的消耗速率等于A2的消耗速率
D. 容器中各组分的体积分数不随时间变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法中,正确的是

A.图中A、B、D三点处Kw的大小关系:B>A>D
B.25℃时,向pH=1的稀硫酸中逐滴加入pH=8的稀氨水,溶液中c(NH4+)/c(NH3·H2O)的值逐渐减小
C.在25℃时,保持温度不变,在水中加人适量NH4Cl固体,体系可从A点变化到C点
D.A点所对应的溶液中,可同时大量存在Na+、Fe3+、Cl-、SO42—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列问题:
(1)有下列物质:①NaOH②Fe③NaHCO3④CH3COOH⑤NH4Cl⑥H2O⑦稀硫酸⑧ NH3·H2O
属于强电解质的有__________;属于弱电解质的有__________。(填序号)
(2)纯净的乙酸又称冰醋酸。在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示。请回答:
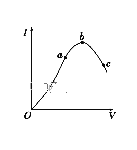
① “O”点导电能力为0的理由是__________。
②a、b、c三点处,溶液的c(H+)由小到大的顺序为__________。
③a、b、c三点处,电离程度最大的是__________。
④食用白醋中,醋酸浓度约为1mol/L,能证明醋酸为弱电解质的是(_____)
A.白醋中滴入石蕊试液呈红色
B. pH试纸显示醋酸的pH为2—3
C.蛋壳浸泡在白醋中有气体放出
D. 白醋加入豆浆中有沉淀产生
E. 取出10 mL醋酸,用pH计测出其pH为a,然后用蒸馏水稀释至100 mL,再用pH计测出其pH为b ,b﹤a+1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com