
分析 分析目标方程式与已知方程式,始终抓住目标反应和已知反应之间的关系应用数学知识由已知方程式推得目标方程式,依据盖斯定律计算解答.
解答 解:已知在常温常压下:
①2CH3OH(l)+2O2(g)═2CO(g)+4H2O(g)△H=-a kJ•mol-1;
②2CO(g)+O2(g)═2CO2(g)△H=-b kJ•mol-1;
③H2O(g)═H2O(l)△H=-c kJ•mol-1;
$\frac{1}{2}(①+②+4×③)$得:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l),依据盖斯定律得:△H=-$\frac{1}{2}$(a+b+4c)kJ•mol-1;
所以CH3OH(l)燃烧热的热化学方程式为依据盖斯定律得CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-$\frac{1}{2}$(a+b+4c)kJ•mol-1,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-$\frac{1}{2}$(a+b+4c)kJ•mol-1.
点评 本题考查了燃烧热的热化学方程式的书写,明确盖斯定律计算反应热的方法,熟悉燃烧热的概念是解题关键,题目难度不大.


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案科目:高中化学 来源: 题型:解答题
| 元素 | 结构及性质 |
| A | A单质是生活中的常见金属,它有两种氯化物,相对分子质量相差35.5 |
| B | B原子最外层电子数是内层电子总数的$\frac{1}{5}$ |
| C | C是常见化肥的主要元素,单质常温下呈气态 |
| D | D单质被誉为“信息革命的催化剂”,是常用的半导体材料 |
| E | 通常情况下,E没有最高正化合价,其单质之一是空气的一种主要成分 |
| F | F是周期表中元素原子半径最小的,其单质常温下是密度最小的气体 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
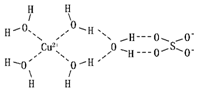 1915年诺贝尔物理学奖授予HenryBragg和LawrenceBragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
1915年诺贝尔物理学奖授予HenryBragg和LawrenceBragg,以表彰他们用X射线对晶体结构的分析所作的贡献.| 晶体 | NaCl | KC1 | CaO |
| 晶格能/(kJ•mol-1) | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=10的CH3COONa溶液中,水电离产生的c(OH-)=1×10-10mol•L-1 | |
| B. | pH=a的氨水溶液,稀释10倍(溶液体积变为原来10倍)后,其pH=b,则a<b+1 | |
| C. | pH=3的H2S溶液与pH=11的NaOH溶液任意比例混合:C(Na+)+c(H+)=c(OH-)+c(HS-) | |
| D. | pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的:c(Na+)大小顺序为①<②<③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 描述一 | 描述二 | |
| A | 淀粉和纤维素互为同分异构体 | 乙酸和乙酸乙酯互为同系物 |
| B | 金刚石和石墨互为同素异形体 | O2和O3互为同位素 |
| C | SO2和NO2都属于大气污染物 | pH小于7的雨水就属于酸雨 |
| D | 正反应活化能小于逆反应活化能的反应属于放热反应 | 反应物能量总和大于生成物能量总和的反应属于放热反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
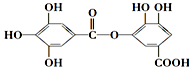
| A. | 有弱酸性,1mol该有机物与溴水反应,最多能消耗4mol Br2 | |
| B. | 在一定条件下,1mol该物质最多能与7mol NaOH完全反应 | |
| C. | 在Ni催化下,1mol该物质可以和8mol H2发生加成反应 | |
| D. | 它能发生水解反应,水解后只能生成两种产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
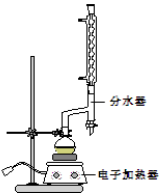 苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为:
苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为: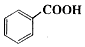 +C2H5OH$\stackrel{H_{2}SO_{4}}{?}$
+C2H5OH$\stackrel{H_{2}SO_{4}}{?}$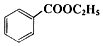 +H2O
+H2O| 颜色、状态 | 沸点(℃) | 密度(g•cm-3) | |
| 苯甲酸* | 无色片状晶休 | 249 | 1.2659 |
| 苯甲酸乙酯 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 无色澄清液体 | 80.8 | 0.7318 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ①②⑤ | C. | ②③④⑤ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
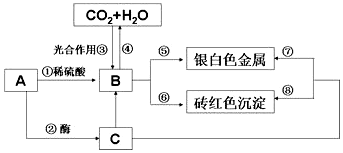
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com