
分析 具有相同质子数、不同中子数的原子为同位素;
具有相同分子式、不同结构的有机物互为同分异构体;
结构相似,分子组成相差n个CH2原子团的有机物互为同系物;
同种元素的不同单质,互为同素异形体;
分子式相同、结构相同的物质为同一种物质,以此来解答.
解答 解:以上几种物质中,只有③中为具有相同质子数、不同中子数的原子,二者为同位素;
只有①中为同种元素形成的不同单质,互为同素异形体;
只有④⑤中的物质,结构相似,分子组成相差n个CH2原子团,互为同系物;
只有⑦⑧⑨中的物质具有相同分子式、不同结构,互为同分异构体;
故答案为:③;①;④⑤;⑦⑧⑨;
点评 本题考查五同概念的辨析,为高频考点,把握概念中的要点为解答的关键,注意②中物质均为水为解答的易错点,注重基础知识的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用红外光谱法鉴别乙醇和二甲醚 | |
| B. | 用酸性高锰酸钾溶液鉴别乙烷和乙炔 | |
| C. | 用碘水鉴别苯和四氯化碳 | |
| D. | 用溴的四氯化碳鉴别乙烯和乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
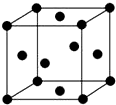 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期,E位于第四周期.A位于周期表中的s区,其原子中电子层数和未成对电子数相同;B的基态原子中的核外电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外电子总数是最内层电子总数的4倍.同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面.A、B两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期,E位于第四周期.A位于周期表中的s区,其原子中电子层数和未成对电子数相同;B的基态原子中的核外电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外电子总数是最内层电子总数的4倍.同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面.A、B两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 比例模型 :可以表示二氧化碳分子,也可以表示水分子 :可以表示二氧化碳分子,也可以表示水分子 | |
| B. | 室温下,将0.4mol/L HA溶液和0.2mol/LNaOH溶液等体积混合(忽略混合时溶液体积的变化)测得混合溶液的pH=5,则混合溶液中由水电离出的c(H+)=1×10-5mol/L | |
| C. | 纯碳新材料“碳纳米泡沫”,每个泡沫含有约4000个碳原子,直径约6到9nm,在低于-183℃时,泡沫具有永久磁性,“碳纳米泡沫”与石墨互为同位素 | |
| D. | 已知 Ag2CrO4的Ksp为1.12×10-12,则将等体积的1×10-4 mol•L-1的AgNO3溶液和1×10-4 mol•L-1 K2Cr04溶液混合,不会有Ag2CrO4沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
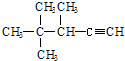 的系统名称为( )
的系统名称为( )| A. | 2,2,3-三甲基-1-戊炔 | B. | 3,4,4-三甲基-4-戊炔 | ||
| C. | 3,4,4-三甲基-1-戊炔 | D. | 2,2,3-三甲基-4-戊炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(H2)=0.03 mol/(L•min) | B. | v(N2)=0.02mol/(L•min) | ||
| C. | v(NH3)=0.17mol/(L•min) | D. | v(NH3)=0.01mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
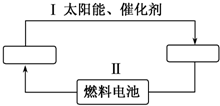 氢能源是21世纪极具发展前景的新能源之一,它既是绿色能源,又可循环使用.请在如图中的两个空格中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在).
氢能源是21世纪极具发展前景的新能源之一,它既是绿色能源,又可循环使用.请在如图中的两个空格中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
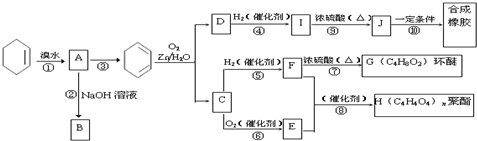
 ; COHC-CHO
; COHC-CHO +2nH2O,
+2nH2O,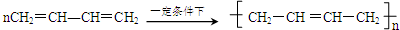
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com